Hasta hace unos pocos años, se podían tratar los síntomas de estas enfermedades, pero no había forma de curarlas de raíz. La terapia génica, experimentada por vez primera en Estados Unidos en 1990, es un conjunto de técnicas que tienen como objetivo, una vez finalizada la prolongada fase experimental, reemplazar los genes con ADN defectuoso de los enfermos y así resolver el problema desde su causa.
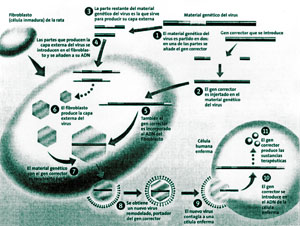
Sin embargo, entre la idea y su realización hay un serio obstáculo: encontrar un vehículo inocuo y estable para transportar los genes correctores. Los investigadores apuestan por el uso de virus. Los manipulan en laboratorio, para hacerlos inofensivos e injertar en su interior el gen sano. Aprovechan así su capacidad natural para introducirse en las células y volcar en el núcleo su propio material genético.
Los virus más empleados son los retrovirus (como el de la leucemia de los ratones, inofensivo para los hombres) y los adenovirus (por ejemplo, el virus del resfrío). Los retrovirus insertan sus genes directamente en el ADN (no genéricamente en el núcleo) de la célula infectada y aseguran resultados más duraderos. Su principal defecto es que tienden a infectar sólo las células que se encuentran en fase de división. Los adenovirus, por el contrario, actúan también en las células que no se reproducen pero no garantizan resultados prolongados, puesto que sus genes no se insertan directamente en el ADN. También se han hecho pruebas con liposomas, unas cápsulas formadas por partículas grasas que penetran a través de la membrana celular, y con fragmentos de ADN desnudo.
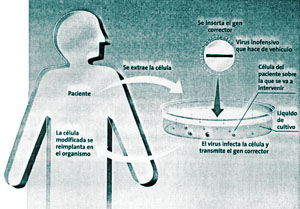
Se suelen utilizar los retrovirus para las inmunodeficiencias y las enfermedades de la sangre, como la talasemia, una anomalía patológica hereditaria que se caracteriza por bajos niveles de hemoglobina en los glóbulos rojos. Se extraen unas células del paciente y se infectan con retrovirus en el laboratorio. Luego se reinsertan en el organismo. (ver gráficos a continuación).
Para las enfermedades del sistema nervioso, en cambio, se emplean adenovirus que se inyectan directamente en el tejido cerebral del paciente. También se está estudiando la posibilidad de emplear los lentivirus, el grupo al que pertenece el virus del SIDA, que reúnen las ventajas de todos los usados hasta ahora: al igual que los adenovirus, son capaces de infectar también las células que no se reproducen y, como los retrovirus, vuelcan sus genes directamente en el ADN del huésped.
Gran parte de los tratamientos se encuentran aún en fase de experimentación preliminar. Para hacerlos eficaces, los investigadores deberán salvar dos grandes obstáculos: el problema del rechazo y el de la permanencia del ADN instalado. El sistema inmunológico del paciente ataca a los virus portadores del gen sano y mata a gran parte de ellos antes de que puedan llegar a su objetivo, las células diana. A veces también ellas rechazan el gen extraño y lo neutralizan. Es necesario encontrar un truco que pueda engañar estas defensas naturales.
El problema de la permanencia de los genes correctores en el organismo se presenta cuando se interviene en células de vida breve, como los glóbulos rojos. Con su muerte, los efectos de la terapia se pierden. El objetivo es aislar las células que están en el origen de todas las de la sangre y del sistema inmunológico, y corregir el ADN defectuoso directamente en ellas. Cuando se logre, los efectos del tratamiento serán duraderos y no habrá necesidad de repetirlo periódicamente.
Intervenciones sobre las enfermedades hereditarias
Un método de terapia génica consiste en extraer las células del paciente sobre las cuales se quiere intervenir, introducirles los genes correctores y reinsertarlas en el organismo. Se utiliza, por ejemplo, para curar la hipercolesterolemia familiar (grave exceso de colesterol debido a razones hereditarias) y algunas clases de tumores.
En otros casos el gen puede entrar directamente en el organismo; en el caso de la fibrosis quística se introduce en el aparato respiratorio.
Manipulación con buen fin
Para curar una enfermedad debida a una anomalía hereditaria, se introduce un gen corrector, usando como vehículo un virus, una vez manipulado para dejarlo inactivo. El virus, remodelado para producir el gen corrector, contagia la célula del organismo del paciente e introduce su patrimonio genético en el de la célula enferma. Así le transmite también el gen corrector, que produce la sustancia útil para la terapia.
Una trampa contra el cáncer
Al contrario de las enfermedades hereditarias, causadas por el defecto de un gen en particular, los tumores tienen origen habitualmente en una serie de mutaciones del patrimonio genético de una célula, que se acumulan en el tiempo hasta modificar sus características y su comportamiento. La investigación sobre la terapia génica aplicada al cáncer es muy compleja, porque las formas tumorales son muy diversas, así como los genes implicados.
Uno de los blancos a tratar es el gen p53, que normalmente se activa cuando el ADN se daña de forma irreparable y obliga a la célula a suicidarse. Si está defectuoso, la célula sobrevive a esta muerte programada y las mutaciones se almacenan en su patrimonio genético. En más de la mitad de las formas tumorales se hallan presentes anomalías en el p53. Se encuentra en estudio un método para insertar copias correctas en las células enfermas, utilizando retrovirus manipulados.
El estadounidense Paul Blezinger de la compañía Gene-Medicine, ha ideado una nueva estrategia para matar al cáncer de hambre y sed. Judah Folkman demostró que la expansión de este mal se puede frenar si se bloquea el proceso de angiogénesis, la creación de vasos que necesitan los tumores para alimentarse y reproducirse. Dos proteínas naturales, la endostatina y la angiostatina, inhiben este proceso, pero su creación en laboratorio es costosa y extremadamente complicada. El equipo de Blezinger ha demostrado, en un experimento con ratones, que la producción de endostatina se puede estimular en el interior del organismo mediante un gen. Un fragmento de ADN, transportado en un polímero e insertado en el músculo esquelético de roedores produjo los resultados esperados. La técnica, sin embargo, tendrá que perfeccionarse mucho antes de aplicarse a personas.
Una nueva terapia intenta combatir el glioma, un tumor cerebral muy agresivo. Utilizando el virus herpes simplex-1, los investigadores transfieren en el ADN de las células enfermas el gen responsable de la producción de una proteína, la timidina quinasa, que actúa como trampa para la medicación. Después de la infección, se administra un fármaco, el ganciclovir, que mata selectivamente las células que contienen timidina chinasi (ver gráfico a continuación).

Un equipo de la Universitè Pierre et Marie Curie, en París, ha puesto en entredicho esta técnica, al demostrar en ratas que puede producir una inflamación crónica y la pérdida de mielina, la vaina que recubre las fibras nerviosas.
Un método distinto consiste en suministrar vacunas curativas contra el cáncer. Las células tumorales interponen una serie de estrategias que obstaculizan la labor defensiva del sistema inmunológico. El fin de estas vacunas es precisamente potenciar esa respuesta natural del organismo, utilizando las proteínas que la activan o bien transfiriendo al ADN de las células enfermas los genes responsables de su síntesis para aumentar su producción. Los resultados han sido prometedores en el caso del carcinoma de colon, el melanoma de piel y el tumor de mama. Un equipo de la Universidad John Hopkins (Baltimore) ha obtenido buenos resultados contra el cáncer de próstata, insertando en las células afectadas el gen que produce la proteína GM-CSF. Gracias a esta vacuna, el organismo reconoce las células tumorales como una infección y las ataca.