El origen
de los vasos sanguíneos
La formación de los vasos sanguíneos está programada
genéticamente y controlada por determinantes ambientales locales,
pero los mecanismos involucrados solo se conocen parcialmente. Comprender
estos mecanismos a nivel celular y molecular es fundamental para poder
controlar enfermedades y para promover el desarrollo de órganos
artificiales usando técnicas de ingeniería genética.
Alda Trufó
Department of Pediatrics
University of Virginia School of Medicine, Charlotteville, EEUU
En todos los mamíferos el oxígeno necesario
para la vida es transportado por la sangre que circula en los vasos sanguíneos,
los cuales son imprescindibles para el desarrollo y funcionamiento de
todos los órganos.
En condiciones normales, la estructura y distribución de los vasos
sanguíneos de cada órgano es constante y está determinada
genéticamente. Si durante la vida embrionaria los vasos no se desarrollan
adecuadamente los embriones mueren por falta de oxigenación de
órganos vitales tales como el corazón o el riñón,
si crecen desordenadamente se originan graves enfermedades congénitas,
y cuando crecen en exceso se forman tumores vasculares.
En la vida adulta la formación de nuevos vasos se produce sólo
en el útero durante el ciclo menstrual, en la placenta durante
el embarazo y en los procesos de cicatrización. Por ejemplo, si
luego de un infarto no crecen nuevos vasos, la zona dañada del
músculo cardíaco muere debido a la falta de oxígeno
y se transforma en una cicatriz fibrosa. Enfermedades tan diversas como
diabetes, artritis o retinopatía del prematuro se complican a raíz
del desarrollo anormal de vasos sanguíneos, y el crecimiento de
los tumores malignos depende en gran medida de los vasos sanguíneos
que permiten su oxigenación (véase el recuadro ‘’).
Tanto en condiciones normales como patológicas, el desarrollo vascular
-también denominado angiogénesis en forma general- depende
de la tensión de oxígeno. La carencia de oxígeno
produce una respuesta local que se caracteriza por la liberación
de factores de crecimiento especializados denominados factores angiogénicos.
Los principales son el factor de crecimiento endotelial (o VEGF por Vascular
Endothelial Growth Factor), las angiopoietinas y el factor de crecimiento
de fibroblastos (FGF; por Fibroblast Growth Factor). Estas moléculas
inducen la formación de nuevos vasos, lo cual en algunos casos
es beneficioso -en el desarrollo embrionario o la reparación de
un infarto, por ejemplo-, pero a veces generan un nuevo problema. Por
ejemplo, en la retinopatía diabética o del prematuro la
formación de vasos en la retina causa pérdida de la visión.
Estudio del desarrollo vascular
Los primeros estudios consistieron en meticulosas observaciones morfológicas
en distintos estadios de la vida embrionaria comparadas con la anatomía
normal del individuo adulto. Se obtuvo así un gran cúmulo
de información sobre la forma y distribución de los vasos,
y sobre la secuencia cronológica de su desarrollo.
El conocimiento más reciente sobre el desarrollo vascular proviene
de experimentos en los cuales se inactivaron genes imprescindibles para
dicho desarrollo usando las llamadas técnicas del knock out genético.
Debido al papel fundamental que desempeñan varios de los genes
estudiados, su inactivación fue letal. Si bien esto demostró
su importancia, no fue posible estudiar la función de dichos genes
en etapas posteriores del desarrollo, cuando se forman la mayor parte
de los órganos vitales -proceso denominado organogénesis-.
Comenzaron entonces a utilizarse otros modelos experimentales -que denominamos
in vitro-, en los que se estudian órganos o células aisladas.
A continuación se resumen los resultados combinados de ambos tipos
de experimentos realizados en varios laboratorios, incluido el nuestro.
Como veremos en los párrafos que siguen, la pregunta fundamental
que nos hacemos ¿cómo crecen los vasos sanguíneos?,
requiere ser contestada a varios niveles.
Desarrollo de los vasos sanguíneos desde el punto de vista morfológico
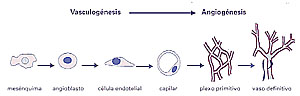
El desarrollo vascular empieza en el embrión cuando las células
del mesodermo -o sea la capa media del embrión- se diferencian
produciendo primero angioblastos y luego células endoteliales (Figura
1). Las células endoteliales se alinean, luego se ponen en contacto
y desarrollan un hueco en su centro, formando un tubo que llamamos capilar
sanguíneo. Los capilares forman inicialmente una red que se denomina
plexo vascular primitivo. Luego algunos capilares desaparecen y otros
se cubren de células musculares, constituyendo el árbol
vascular definitivo (Figura
1). Ampliar
Desarrollo vascular a nivel molecular
Los procesos esquematizados en la Figura 1 son el resultado de la acción
de varios factores angiogénicos que, a través de sus receptores
específicos, transmiten señales al interior de las células
endoteliales o sus precursoras. Dichas señales favorecen el crecimiento
de las células -aumentando su proliferación o su tamaño-,
o provocan su diferenciación induciendo cambios de forma o función.
Otras señales hacen que las células adquieran cierta resistencia
a la muerte celular programada -señal de supervivencia-, o que
se muevan induciendo migración.
Tanto los factores angiogénicos como sus receptores son proteínas;
como mencionamos antes, los factores son el VEGF; sus cuatro receptores
-VEGFR1, VEGFR2, neuropilinas 1 y 2- y las angiopoietinas 1 y 2 y su receptor
Tie2. El VEGF; actuando a través de sus receptores, es el responsable
de la diferenciación y proliferación de los angioblastos
y de las células endoteliales, o sea de todos los procesos que
resultan en la formación del plexo vascular primitivo -vasculogénesis-;
también contribuye a la construcción del árbol vascular
definitivo -o angiogénesis-.
Se ha establecido que los receptores del VEGF le permiten emitir diferentes
señales hacia el interior de las células, pero solo se conoce
parcialmente el modo en que las células endoteliales discriminan
las señales transmitidas por uno u otro receptor. Por su lado,
las angiopoietinas contribuyen facilitando la remodelación y la
bifurcación de nuevos vasos.
Todas estas proteínas se producen, durante el desarrollo embrionario,
en una secuencia temporal y espacial determinada. El paso inicial, inducido
por la escasez de oxígeno, es la producción de VEGF por
células indiferenciadas del mesénquima.
El VEGF induce la producción de uno de sus propios receptores -el
VEGFR2- en algunas células, las que se diferencian formando angioblastos.
Los angioblastos se multiplican, se diferencian transformándose
en células endoteliales y producen otros receptores -el VEGFR1
y el Tie2- que participan en el ensamble y la bifurcación de los
capilares. De este modo, el proceso se amplifica e involucra otras proteínas
-integrinas y FAK quinasas- que posibilitan la migración de las
células endoteliales en direcciones específicas para formar
los vasos sanguíneos en posición adecuada. Cuando los órganos
empiezan a formarse, los vasos crecen con características y distribución
particulares para cada uno de ellos. Todavía no está claro
si cada órgano emite señales propias o si lo que varía
es la secuencia de las mismas y su orientación espacial, lo cual
parece ser lo más probable.
Desarrollo vascular del riñón
Los riñones filtran y eliminan productos de desecho de la sangre
a través de la formación de orina, y regulan la presión
arterial y el contenido de agua y sales del organismo. Cada riñón
humano está formado por aproximadamente un millón de unidades
de filtración llamadas nefrones. A su vez, cada nefrón está
formado por un glomérulo -el filtro propiamente dicho- y un túbulo
que modifica el filtrado mediante la reabsorción o secreción
selectiva de iones o moléculas a través de las células
que forman su pared. El fluido que queda en los túbulos forma la
orina.
Durante el desarrollo embrionario los nefrones y los vasos se forman simultáneamente,
de modo tal que los capilares penetran los glomérulos y rodean
los túbulos. El patrón de distribución de los vasos
sanguíneos en el riñón es muy preciso, y se reproduce
en forma casi idéntica en todas las especies, desde los peces a
los humanos.
Es probable que esto sea el resultado de la selección natural,
ya que las características y ubicación de los vasos son
necesarias para la secreción y reabsorción de moléculas
del filtrado glomerular y para la regulación de la presión
arterial, es decir para la función normal del riñón.
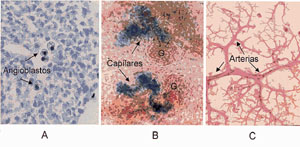 (Figura
2). Ampliar
(Figura
2). Ampliar
Los estudios de la vascularización del riñón embrionario
aislado y en cultivo demostraron que el VEGF induce sucesivamente la diferenciación
de angioblastos en células endoteliales, su proliferación
y la formación de capilares in situ (Figura 2A). El VEGF producido
por el riñon embrionario también atrae células endoteliales
provenientes de fuera del riñón (Figura 2B) hacia los glomérulos
-filtros donde ocurre la filtración de la sangre y se inicia la
formación de la orina (Figura 2C)-. Más tarde, el VEGF induce
la formación de fenestras, microscópicas ventanas en los
capilares que facilitan la permeabilidad necesaria para el enorme transporte
de fluidos y solutos que ocurre en el riñón (Figura 3).
En el riñón el VEGF es producido y liberado por las células
epiteliales que forman los nefrones. Una parte del VEGF difunde libremente
y otra queda ligada a la matriz que une las células, o sea que
se genera un gradiente de concentración de VEGF que serviría
de atracción y guía para la migración de los capilares.
Los capilares se desplazan hasta quedar adyacentes a las células
epiteliales productoras de VEGF en los glomérulos y alrededor de
los túbulos al completarse el desarrollo del órgano
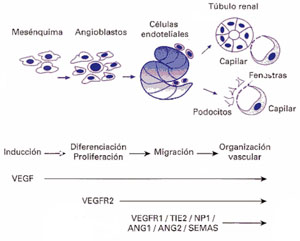
(Figura 3). Ampliar
Para que las células endoteliales de los capilares puedan migrar
hacia las células epiteliales, los receptores de VEGF se asocian
con otras proteínas (integrinas y FAK, o quinasa de adhesión
focal) que son importantes para lag adhesión y el movimiento celular.
Estas proteínas, a su vez, están conectadas con las fibras
que constituyen el esqueleto celular. De este modo, las señales
de migración del VEGF son transformadas en movimiento celular con
una dirección determinada.
Otro grupo de proteínas que probablemente contribuya a establecer
la dirección y ubicación espacial de los vasos sanguíneos
renales son las semaforinas, que han sido extensamente estudiadas en relación
al desarrollo del sistema nervioso.
Las semaforinas son importantes guías moleculares para la migración
de axones -las prolongaciones de las neuronas que forman los nervios-
y comparten con VEGF algunos de los receptores de este (neuropilinas 1
y 2). El riñón embrionario produce varios tipos de semaforinas
cuyas funciones no han sido aún dilucidadas. Dos de ellas -la 3A
y 3F- son producidas por las mismas células epiteliales que producen
VEGF. La semaforina 3A repele las células endoteliales, es decir
que tiene un efecto opuesto al VEGF. Es posible entonces que la dirección
de la migración de las células endoteliales sea la resultante
del efecto opuesto de VEGF y semaforinas.
En resumen, el sistema formado por VEGF, sus receptores y sus respectivas
señales intracelulares establecen los mecanismos fundamentales
para el desarrollo de la vasculatura renal, pero son ‘ayudados’
por otras proteínas, tales como las angiopoietinas, integrinas
y semaforinas.
Angiogénesis: de la biología al tratamiento
Los inhibidores de la angiogénesis son útiles para el tratamiento
del cáncer experimental ya que, al disminuir la irrigación
de los tumores, estos se reducen de tamaño. La mayor utilidad de
estos fármacos radica en potenciar el efecto terapéutico
de la quimioterapia y la radioterapia. La naturaleza química y
el mecanismo de acción de estos inhibidores es múltiple:
anticuerpos anti-VEGF, anticuerpos anti-receptores de VEGF, receptores
solubles que neutralizan VEGF antes de que actúe sobre las células,
pequeñas moléculas que bloquean los mensajes intracelulares
de VEGF y de otros factores angiogénicos. Otros inhibidores, como
el interferón, disminuye la producción y/o liberación
de VEGF. Varios inhibidores están siendo probados actualmente en
ensayos clínicos y se espera que sean aceptados en la práctica
médica en unos pocos años, como coadyuvantes de los tratamientos
tradicionales del cáncer, retinopatía, diabética
y artritis.
La angiogénesis terapéutica para isquemia de miocardio o
de los miembros inferiores también está en fase preclínica.
Estudios experimentales en animales y algunos casos aislados en humanos
han demostrado que VEGF induce angiogénesis y que los nuevos vasos
son funcionales, es decir se conectan con la vasculatura normal preexistente
y mejoran la isquemia. El problema mayor radica en cómo dirigir
el VEGF a los tejidos u órganos blanco y mantenerlo activo el tiempo
necesario para obtener el efecto deseado. Las opciones en estudio son
administrar VEGF por minibomba, o mediante diversas formas de terapia
génica. Todas estas opciones tienen ventajas y problemas que deben
ser definidos y solucionados para cada aplicación específica.
Debido al enorme potencial terapéutico de la inhibición
o promoción de la angiogénesis, y al interés económico
que deriva de él, se investiga muy intensamente en todas estas
áreas y es probable que los obstáculos descriptos se resuelvan
en poco tiempo.
Lecturas sugeridas
• JAIN RK and CARMELIET, 2001, ‘Vessels of death or life’,
Scientific American. Dec.
• NAKAMURA F et al., 2000, ‘Molecular basis of semaphorin-mediated
axon guidance’, J Neurobiol., 44(2):219-229.
• RISAU W, 1995, ‘Differentation of endothelium’, FASEB
Journal, 9:926-933.
• SHIMA DT AND MAIHLOS C, 2000, ‘Vascular developmental biology:
getting nervous’, Curr Opin Genet Dev, 10(5):536-542.
• TUFRO-MCREDDIE A et al., 1997, ‘Oxygen regulates VEGA-induced
vasculogenesis and tubulogenesis’, dev biol, 183:139-149.
• TUFRO A, 2000, ‘Vascular endotelial growth factor spatially
directs angiogenesis in metanephric development in vitro’, Dev Biol,
227:558-566.
|