¿Por
qué se disemina el cáncer?
Las células de los tumores malignos tienen la capacidad de diseminarse
por vía sanguínea o linfática y anidar en otros órganos
dando lugar a tumores secundarios. Este proceso, denominado metástasis,
resulta de una compleja interacción entre las células normales
y las tumorales. La producción de metástasis es una de las
principales causas de muerte por cáncer. De allí la importancia
de desarrollar métodos para evitarlas. Estos métodos requieren
la investigación detallada del mecanismo de producción de
metástasis.
El Comité de Redacción de Acta Bioquímica
Clínica Latinoamericana ha seleccionado este artículo publicado
en la revista “Ciencia Hoy”, Vol. 13 n.º 73, febrero/marzo
2003 para su difusión a través de FABA Informa.
Elisa Bal de Kier Joffé y Lydia Inés
Puricelli Ärea Investigación, Instituto de Oncología
‘Angel H Roffo’ (UBA)
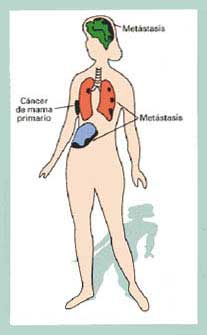
La existencia de metástasis –esto es, la diseminación
de un tumor a distintas zonas del organismo–, fue demostrada en
1829 por Recamier, quien comprobó que los tumores secundarios se
originan de células que se desprenden del tumor primario. La diseminación
de células tumorales es un proceso de profundo significado clínico
dado que las metástasis hacen fracasar los tratamientos, como el
quirúrgico, que eliminan el tumor primario. La diseminación
metastásica es la responsable de una gran proporción de
las muertes por cáncer (entre el 50 y el 66 por ciento), siendo
una de las principales causas del temor que produce esta enfermedad (ver
recuadro ‘¿Por qué fracasa el tratamiento del cáncer?’).
¿Por qué fracasa el tratamiento
del cáncer?
Diagnóstico tardío
• Tumores grandes.
• Diseminación precoz.
• Metástasis de primario oculto.
Localización del tumor y/o metástasis
en órganos vitales.
Daños por compresión o por invasión
local
Toxicidad de los tratamientos
Heterogeneidad tumoral
• Inestabilidad génica y generación
de células más malignas.
• El tumor primario difiere de las
metástasis, y estas entre sí, en su respuesta a los tratamientos.
Por lo tanto, el conocimiento de los mecanismos por los cuales se produce
la diseminación de los tumores es uno de los factores cruciales
para lograr su curación. En consecuencia, en los últimos
años se ha puesto énfasis en la necesidad de definir mejor
a este proceso en sus niveles bioquímico, biológico y molecular.
Se ha logrado así avanzar en la identificación de sustancias
que determinan el comportamiento de la célula metastásica
y se ha explorado si éstas pueden ser de utilidad como marcadores
para el diagnóstico precoz y/o como ‘blanco’ de tratamientos
que permitan prevenir la aparición o la curación de la diseminación
tumoral. Debido a dificultades tanto éticas como prácticas
que conllevan la realización de estudios de este tipo en el ser
humano, se utilizan diversos métodos experimentales en animales
como los que están descriptos en el recuadro ‘Estrategias
experimentales para estudiar la progresión tumoral’.
El conocimiento de los mecanismos por los cuales se produce la diseminación
tumoral es de importancia crucial para alcanzar la curación del
cáncer.
Mecanismos de la progresión tumoral
La metástasis es consecuencia de un complejo proceso selectivo
en el que intervienen múltiples factores. A pesar de la enorme
importancia médica de sus efectos, la metástasis es un fenómeno
altamente ineficiente, ya que solo el 0,1 por ciento de las células
que se desprenden de un tumor y pasan a la circulación dan lugar
a tumores secundarios. En las múltiples etapas de la metástasis
(cascada metastásica), participan factores inherentes a la célula
tumoral, mecanismos de defensa del huésped y un conjunto de interacciones
entre la célula maligna y las células normales del organismo
portador del tumor.
Una vez que se ha desarrollado el tumor primario, una o más células
tumorales pueden disociarse de éste, invadir los tejidos del huésped,
viajar por la corriente sanguínea y/o linfática, escapando
de la vigilancia inmunológica y detenerse en un órgano ‘blanco’
para proliferar y formar un tumor secundario
Figura 1
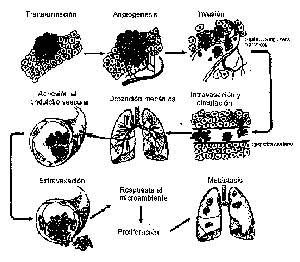
(Ampliar
Fig. 1).
Es obvio que para que una célula sea capaz de desarrollar una metástasis
debe atravesar exitosamente todas las etapas de esta secuencia. Si bien
con fines didácticos cada una de las etapas se suele discriminar
considerándola un proceso aislado, es necesario tener en cuenta
que en realidad el proceso es dinámico y que el pasaje de una etapa
a otra de la cascada es ininterrumpido e incluso puede ser simultáneo.
Además se acepta que los tumores metastásicos tienen en
sí mismos la potencialidad de reiniciar la cascada y metastatizar
a sitios terciarios que se constituyen en metástasis de metástasis.
Se ha demostrado que los tumores no siempre tienen, desde su formación,
todas las propiedades necesarias para alcanzar la etapa final de diseminación.
Se acepta que esta etapa se logra a través de un proceso en el
que participan la adquisición gradual de nuevas características
genotípicas y fenotípicas a medida que el tumor crece, y
la modulación transitoria del comportamiento de la célula
tumoral en los diferentes microambientes que esta atraviesa. Si bien hay
excepciones, se acepta que un tumor tiene la tendencia de empeorar gradualmente,
comportamiento que se designa como progresión tumoral en la cual
la aparición de células metastásicas representa la
etapa culminante del proceso de transformación neoplásica.
De lo dicho hasta ahora resulta claro que el estudio de la progresión
tumoral abarca todas las áreas de la biología tumoral. Estas
incluyen al sistema inmune. El papel de este sistema no se analizará
aquí ya que la orientación principal de este artículo
es describir lo que se sabe sobre la biología de las metástasis
y sobre las moléculas potencialmente responsables de este proceso.
Mecanismos de la invasión tumoral
En varios de los pasos de la cascada metastásica (Fig.
1) la diseminación depende de la capacidad de las células
tumorales de invadir o infiltrar a los tejidos normales adyacentes. Durante
la invasión desde el tumor primario, las células cancerosas
migran hasta penetrar en los vasos sanguíneos o linfáticos.
La invasión secundaria abarca la extravasación y la migración
a través de las estructuras extracelulares del órgano ‘blanco’
(que es el que recibe la metástasis), hasta que se produce el crecimiento
de un nódulo metastásico. Es importante destacar que invasiones
celulares fisiológicas como el crecimiento de los precursores de
las neuronas en el embrión o el proceso de cicatrización
transcurren a través de mecanismos moleculares similares a la invasión
maligna, y que la principal diferencia es la persistencia de la invasión
maligna que contrasta con el carácter controlado y limitado de
los procesos normales.
Durante la invasión se produce una serie de interacciones entre
las células tumorales con las matrices extracelulares (ME). Las
ME son redes complejas de macromoléculas secretadas por distintas
células que se ensamblan en forma local y que cumplen importantes
funciones para el adecuado funcionamiento de los tejidos. Una variante
particular de estas matrices aparece en las células de los tejidos
llamados epiteliales, que se apoyan sobre una forma especial de ME altamente
organizada propia de estos tejidos llamada membrana basal (MB). En los
tumores de origen epitelial (carcinomas), que constituyen más del
80 por ciento de los tumores humanos, se altera profundamente la organización
de las ME y las MB son modificadas y atravesadas varias veces a lo largo
de la cascada metastásica.
Recientemente se ha postulado que el cáncer podría considerarse
un desequilibrio patológico entre diferentes sociedades celulares,
en el cual en la zona de contacto entre las células tumorales y
las normales se crea un microecosistema invasor.
La transformación en invasor de un carcinoma está precedida
por la activación local de diversas células (fibroblastos,
células inmunes y endotelio).
La invasión ocurre en esa zona focalizada, y se acompaña
de la interacción y cooperación entre las células
tumorales y las normales, proceso que incluye el reconocimiento y el intercambio
de enzimas y de otras sustancias que son producidas por el sistema inmune
como las citoquinas (Fig. 2).
Microambiente en la zona de invación tumoral:
interacción entre células normales y tumorales
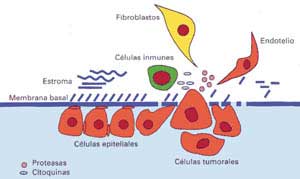 Figura
2 Figura
2
Se ha propuesto que tanto la invasión tumoral primaria como la
secundaria se inician con la adhesión de la célula neoplásica
a las ME, seguida por la disolución de estas por enzimas que digieren
las proteínas (enzimas proteolíticas) y la posterior migración
de las células a través de las ME así alteradas.
Esta secuencia de tres pasos puede repetirse sucesivamente en varias instancias
durante la invasión. Muchos estudios han demostrado que la célula
maligna produce cantidades inapropiadas -ya sea mayores o menores- de
algunas moléculas específicas, lo que podría determinar
el comportamiento invasor.
La fibronectina (FN) es una glicoproteína (molécula formada
por una proteína a la que se le han unido azúcares) de alto
peso molecular que se encuentra en forma fibrilar e insoluble en la ME
y en forma soluble en el plasma. La FN interactúa con otros componentes
de la ME, así como con las integrinas (moléculas que intervienen
en la adhesión entre células) de la superficie celular.
La formación de células tumorales causa una marcada disminución
en la síntesis de FN y/o produce alteraciones en su capacidad de
ensamblarse en la ME. En experimentos realizados en nuestro Instituto
con adenocarcinomas mamarios de ratón, demostramos que las células
con mayor capacidad metastásica dejan de sintetizar FN. Cuando
las mismas células son inducidas experimentalmente a producir FN,
mediante la introducción (transfección) estable del gen
completo de la FN, se reduce en forma muy significativa su capacidad de
producir metástasis en los pulmones.
La invasión tumoral implica la disolución de la MB. Para
ello es necesaria la presencia de un conjunto de enzimas extracelulares
que catalizan la digestión de proteínas (proteasas (Ampliar
Tabla 1). Entre dichas proteasas se destacan las metaloproteinasas
de matriz (MMPs) y el activador del plasminógeno de tipo uroquinasa
(uPA). Tanto las MMPs como el uPA se han encontrado muy aumentados en
numerosos tumores experimentales y humanos, siendo su medición
de utilidad para predecir la evolución de los pacientes (ver el
artículo ‘Marcadores tumorales’ en este número
de CIENCIA Hoy). Hay evidencias experimentales muy sólidas que
muestran que las proteasas no solo participan en la remodelación
de la ME, sino que desempeñan también importantes papeles
en procesos tales como el crecimiento, la migración y la muerte
de la célula tumoral. La inhibición de estas enzimas mediante
sustancias naturales se o sintéticas constituye una nueva terapéutica
contra las metástasis. En este sentido, recientemente se ha desarrollado
una nueva tecnología que permitirá evaluar, mediante el
diagnóstico por imágenes en pacientes, la efectividad de
los inhibidores enzimáticos.
Las metaloproteasas (MMP) se secretan como protoenzimas latentes (esto
es, como moléculas sin actividad enzimática la que adquieren
luego de su secreción). Entre sus miembros, las gelatinasas o colagenasas
tipo IV son capaces de hidrolizar los colágenos tipo IV (que se
encuentra específicamente en las MB) y tipo V. En particular, la
MMP-2 y la MMP-9 son las enzimas más fuertemente vinculadas con
la capacidad invasora tumoral y con la formación de vasos sanguíneos
(angiogénesis).
El uPA es una serinoproteasa que, además de degradar directamente
algunos componentes de la ME, convierte al plasminógeno en plasmina,
una potente enzima capaz a su vez de amplificar la cascada proteolítica
al activar otras proenzimas.
Asimismo, mediante el empleo de inhibidores sintéticos específicos
del uPA, se demostró que esta proteasa era esencial en la migración
e invasión celular in vitro e in vivo. La activación del
plasminógeno por el uPA se incrementa hasta 40 veces cuando este
está unido a su receptor de membrana (llamado uPAR) focalizando
así el frente de degradación. Cuando existen cantidades
aumentadas de uPA y/o uPAR, además de promoverse la degradación
de la ME, se modifica la señalización intracelular y se
puede producir un incremento de la capacidad de migrar y de crecer de
las células tumorales. En los adenocarcinomas mamarios de ratón
que utilizamos en nuestro laboratorio hemos demostrado que el tumor con
mayor capacidad de formar metástasis secreta 3-4 veces más
uPA que las células normales.
¿Por qué la distribución de
las metástasis depende de la naturaleza del tumor?
La clínica del cáncer indica que la distribución
de las metástasis no es un proceso al azar, sino que depende del
sitio de origen y del tipo de tumor primario. Así, por ejemplo,
las metástasis en el cáncer de mama se producen con preferencia
en los huesos, el pulmón, el cerebro y el hígado y solo
raramente aparecen en otros sitios. Además, algunos tejidos como
el cartílago y el músculo esquelético solo muy raramente
son colonizados por células tumorales.
Se han propuesto varias teorías para explicar la selectividad de
las metástasis. La más simple es la teoría anátomo-mecánica
que postula que las metástasis tienen una determinada ubicación
porque las células que las producen son atrapadas mecánicamente
en una determinada zona. Se sabe que esto ocurre en solo algunos casos
de modo que no todas las distribuciones de células metastáticas
pueden ser explicadas por esta teoría. Otra teoría es la
llamada suelo-semilla, formulada en 1889 por Paget (St. Bartholomew’s
College, Londres).
Está basada en suponer que las células tumorales (semillas)
solo pueden crecer en el órgano cuyo microambiente (suelo) sea
apropiado. Uno de los primeros trabajos experimentales destinados a comprobar
la teoría de Paget fue realizado por Fidler y sus colaboradores
(University of Texas, MD Anderson Hospital, Houston, Texas). Estos investigadores
realizaron experimentos que consistían en implantar en diversos
músculos esqueléticos de ratones, fragmentos de diferentes
órganos normales y después inocular a los animales por vía
endovenosa con células de un melanoma maligno. Luego de 21 días
de inoculación, se comprobó que las células inyectadas
habían formado metástasis en los pulmones del huésped
(que constituye la primera barrera anatómica de la inoculación
endovenosa), pero que también lo habían hecho en el tejido
pulmonar implantado en los músculos. En contraste, no se detectó
crecimiento tumoral alguno en los demás órganos e implantes
musculares de otros tejidos del huésped.
Estos resultados coinciden con la visión actual que acepta el punto
de vista de Paget postulando que la diseminación metastásica
está predominantemente determinada por interacciones específicas
entre la célula maligna y el órgano que recibe la metástasis.
La primera interacción entre las células malignas circulantes
y el órgano ‘blanco’ ocurre a nivel de la sus vasos
sanguíneos más pequeños, donde las células
tumorales entran en contacto con la superficie interna (endotelio) de
los vasos. Estudios in vitro (Ampliar
Tabla)demostraron que las células tumorales se adhieren
con preferencia a los endotelios de los vasos pertenecientes a los órganos
que invaden.
La consideración moderna de la teoría de Paget debe incluir
el concepto de la heterogeneidad tumoral. Así, a pesar de que la
mayoría de los tumores tiene su origen en células monoclonales
(esto es que tienen idéntico genoma), se convierten en heterogéneos
cuando se han desarrollado lo suficiente para permitir su diagnóstico,
de modo que en ese estado se encuentran subpoblaciones que difieren en
características tales como antigenicidad, inmunogenicidad, su capacidad
de producir enzimas y su resistencia a drogas, como así también
en su capacidad de desarrollar metástasis. En muchos tumores se
encuentran en forma temprana subpoblaciones de células con alto
potencial metastásico. Estas serían las seleccionadas por
su eficiencia para superar todas las etapas necesarias para que la metástasis
tenga lugar.
Sin embargo, no se pueden ignorar otras alternativas que explican el complejo
proceso de las metástasis. Por ejemplo, Nicolson postuló
que la adquisición de la capacidad metastásica podría
depender de las inestabilidades transitorias de las células tumorales,
y no de la selección de determinadas células metastásicas
presentes en el tumor primario. Esta teoría está apoyada
por datos experimentales que indican que el microambiente modula, entre
otras propiedades, la abundancia de receptores hormonales, la apoptosis
o muerte celular programada y la resistencia a quimioterápicos.
Por ejemplo, en el caso de un fibrosarcoma murino se observó que
el tumor era sensible al quimioterápico doxorrubicina cuando crecía
en el tejido subcutáneo, mientras que las metástasis pulmonares
eran resistentes a la misma droga, y que esta diferencia estaba asociada
al aumento de la P-glicoproteína que confiere resistencia múltiple
a las drogas.
Es interesante recalcar que la resistencia a los quimioterápicos
no dependería de la selección de subpoblaciones específicas,
sino de las interacciones con el medio ambiente, ya que las células
metastásicas, una vez removidas del pulmón, volvían
a adquirir la sensibilidad a la doxorrubicina.
Las células tumorales podrían encontrar un terreno favorable
para crecer en aquellos órganos que produzcan factores similares
a los que regulan el tejido normal en el que se originó el tumor
primario. Por ejemplo, el carcinoma de colon humano responde a factores
específicos que modulan el epítelio colónico normal.
Es interesante recalcar que algunos de estos factores son idénticos
a los que regulan la renovación tisular hepática, siendo
el hígado el sitio preferencial de metástasis de este tipo
de tumor. Por otro lado, se estableció que algunas sustancias naturales
con efectos inhibitorios sobre determinadas células normales (por
ejemplo la interleuquina IL6 cuyo efecto se ejerce sobre los melanocitos)
actúan como factores estimulantes del crecimiento cuando dichas
células se transforman y forman parte de tumores (por ejemplo melanomas)
avanzados. También se ha demostrado una relación recíproca
entre la célula metastásica y el microambiente del órgano
blanco, ya que la célula tumoral puede liberar factores a los cuales
la célula normal responde, produciendo a su vez factores que estimulan
a la propia célula tumoral.
Desde hace unos años, este grupo está interesado en estudiar
los factores del órgano ‘blanco’ que determinan el
comportamiento metastásico. Estos estudios han permitido demostrar
que factores solubles del pulmón, órgano ‘blanco’
de la diseminación metastásica de los adenocarcinomas mamarios
murinos, son capaces de estimular la proliferación, migración
y secreción de uroquinasa (uPA) in vitro, así como también
de incentivar la angiogénesis y el crecimiento tumoral local y
metastásico in vivo.
Se conoce que existen factores que permiten la sobrevida en el microambiente
tisular. Estos factores, esenciales para el mantenimiento de viabilidad
de la célula normal, podrían tener también influencia
en la sobrevida de la célula metastásica en el órgano
‘blanco’ e, inclusive, llegar a rescatar de las primeras etapas
de la apoptosis a la célula dañada por el tratamiento con
drogas antitumorales. En un trabajo reciente sobre las interacciones entre
la célula tumoral y el órgano blanco, usando un modelo experimental
que solo produce metástasis en el pulmón, demostramos in
vitro e in vivo que factores solubles del pulmón, pero no los del
hígado o el riñón, son capaces de rescatar de la
apoptosis a células tumorales mamarias tratadas con diferentes
quimioterápicos tales como doxorrubicina y cisplatino.
Conclusiones
El conocimiento de los pasos específicos involucrados en el proceso
de invasión y metástasis permitiría predecir el grado
de agresividad tumoral, localizar metástasis silenciosas y desarrollar
tratamientos antimetastásicos más racionales. Frente a esquemas
convencionales, cuyos resultados no son siempre satisfactorios, es preciso
reconocer que la alternativa molecular se presenta como una vía
promisoria para llegar al definitivo éxito en el diagnóstico
y tratamiento de la metástasis.
Sin embargo, es preciso abandonar la idea de que solo unas pocas sustancias
tendrían un papel importante en la formación de metástasis
y aceptar la gran complejidad, a nivel molecular, de este proceso. Nuevas
tecnologías en desarrollo (tales como los microarrays o micromatrices
de expresión molecular) permiten analizar simultáneamente
los productos de miles de genes potenciales marcadores tumorales. Más
aún, recientemente la combinación de estos estudios con
microdisección mediante el uso de láseres ha permitido dilucidar
qué moléculas se encuentran activas (fosforiladas), en los
diferentes microecosistemas tumor-huésped presentes en tejidos
humanos.
Falta aún un largo recorrido hasta que la información que
provee este tipo de estudios se convierta en una herramienta eficaz y
práctica de diagnóstico a nivel clínico. Sin embargo,
no es futurología predecir la aparición de una nueva definición
de los perfiles moleculares tumorales, que probablemente generará
nuevas clasificaciones de los tumores y nuevos conocimientos acerca de
su formación, los que harán posible el diseño de
drogas más específicas.
Lecturas sugeridas:
Aguirre Ghiso J, Alonso D, Farias E, Gomez D, Bal de Kier Joffé
E, 1999, 'Minireview: Deregulation of the signaling pathways controlling
urokinase production, Its relationship with the invasive phenotype' European
Journal of Biochemistry, 263:295-304.
Fidler I, 1999. 'Critical determinants of cancer metastasis: rationale
for therapy', Cancer chemoter. Pharmacol., 43:3-10.
Ladeda V, Adam A, Puricelli L, Bal de Kier Joffé E, 2001, 'Apoptotic
cell death induced by anticancer drugs is prevented by soluble factors
present in the target organ of metastasis', Breast cancer research &
treatment, 69:39-51.
Liotta LA, Kohn EC, 2001, 'The microenvironment of the tumor-host interface',
Nature, 411:375-379.
Urtreger A, Porro F, Puricelli L, Werbajh S, Baralle FE, Bal de Kier Joffé
E, Kornblihtt A, Muro A, 1998, 'Expression of RGD minus Fibronectin that
does not Form Extracellular Matrix Fibrils is Sufficient to Decrease Tumor
Metastasis', International Journal of Cancer, 78:233-241.
Página web htpp://www.cnio.es
 Elisa
Bal de Kier Joffé: Doctora en Medicina (UBA). Directora
Área Investigación del Instituto de Oncología 'Angel
H Roffo'. Miembro de la Carrera del Investigador Científico del
CONICET. Elisa
Bal de Kier Joffé: Doctora en Medicina (UBA). Directora
Área Investigación del Instituto de Oncología 'Angel
H Roffo'. Miembro de la Carrera del Investigador Científico del
CONICET.
Profesor regular adjunto con dedicación parcial. Departamento de
Biología Celular e Histología de la Facultad de Medicina
(UBA).
E-mail: elisabal@mail.fmed.uba.ar

Lydia Puricelli: Doctora en Ciencias
Biológicas, Facultad de Ciencias Exactas y Naturales (UBA). Profesional
investigador del Área Investigación del Instituto de Oncología
'Ángel H Roffo'. Miembro de la Carrera del Investigador Científico
del CONICET. Docente de la carrera de Especialista en Oncología
(UBA).
|