Marcadores
tumorales
Los marcadores tumorales, tanto los presentes en los tejidos como los
circulantes en sangre, son de gran ayuda en la valoración de distintos
aspectos de la biología tumoral. Estos marcadores permiten al oncólogo
clínico diagnosticar, caracterizar, tratar y seguir la evolución
del cáncer.
El Comité de Redacción de Acta Bioquímica
Clínica Latinoamericana ha seleccionado este artículo publicado
en la revista “Ciencia Hoy”, Vol. 13 n.º 73, febrero/marzo
2003 para su difusión a través de FABA Informa.
•Stella Maris Ranuncolo. Departamento de Biología
Celular, Instituto de Oncología ‘Angel H. Roffo’ (UBA).
•Leandro Cerchietti. Unidad de Investigación de Transferencia,
Instituto de Oncología ‘Ángel H. Roffo ‘ (UBA).
Los marcadores tumorales son las moléculas
que permiten detectar la presencia de células tumorales, así
como determinar su origen y prever el pronóstico del paciente.
Estos marcadores pueden identificarse y cuantificarse a nivel tisular
–por ejemplo en una biopsia– o en distintos fluidos fisiológicos,
como suero, plasma, orina o saliva, o patológicos, tales como derrames
pleural, pericárdico, ascitis, etc.
La naturaleza invasora y metastásica de las células tumorales
depende de su capacidad para adherirse a la matriz extracelular, degradar
sus componentes y luego migrar a través de esa matriz parcialmente
degradada. La repetición cíclica de estos tres procesos
permite a la célula tumoral penetrar los tejidos vecinos y alcanzar
la luz de los vasos sanguíneos y linfáticos. Este proceso
depende de la interacción de factores producidos tanto por el huésped
como por el tumor. La caracterización de estos factores reviste
gran interés, dado que proporcionaría información
referida a distintos aspectos del comportamiento biológico del
tumor –por ejemplo, su grado de agresividad–, lo cual ayuda
al médico en el manejo del paciente oncológico.
Son muchos los agentes que pueden ser potencialmente reconocidos como
marcadores tumorales. Estos incluyen los antígenos tumorales –o
sea, proteínas presentes en los tumores que son reconocidas por
el sistema inmunológico del paciente–, enzimas, las cuales
son proteínas que destruyen tejidos del huésped, y permiten
al tumor progresar hacia otros tejidos, metabolitos, productos de oncogenes,
y alteraciones detectables en el ácido desoxirribonucleico (ADN)
tumoral Un marcador tumoral debe ser producido por las células
tumorales –o por células vecinas influenciadas por estas–,
ser específico de tumor y de órgano, detectable en todos
los pacientes con el mismo tipo de tumor y en los estadios iniciales del
crecimiento tumoral, y encontrarse en un fluido biológico –orina,
plasma, suero, etc.– en concentraciones proporcionales al desarrollo
del tumor.
Es deseable que los marcadores permitan detectar la presencia de un tumor
en forma temprana, mucho antes que los métodos convencionales.
Por ejemplo, cuando es posible detectar el tumor por métodos de
diagnósticos por imágenes -la llamada detección precoz-,
la masa tumoral contiene al menos diez mil millones de células,
mientras que un buen marcador tumoral debe ser individualizado cuando
el tumor tiene al menos un número de células cien veces
menor. El marcador tumoral circulante que más precozmente se eleva
es la subunidad â de la gonadotrofina coriónica (â-HCG,
por su sigla en inglés), que es detectable cuando el corioncarcinoma
que la origina consta de solamente un millón de células.
Si bien desde hace muchos años, numerosos investigadores han intentado
desarrollar métodos analíticos capaces de identificar bioquímicamente
productos específicos de los tumores, no todas las moléculas
que se proponen como marcadores tumorales reúnen las propiedades
deseadas. Es por ello que en la actualidad existe una tendencia a emplear
la información proporcionada por más de un marcador.
Existen distintos tipos de marcadores tumorales. Un marcador de susceptibilidad
es aquel que permite identificar personas con mayor riesgo de desarrollar
un determinado tipo de cáncer. Están basados en la detección
de alteraciones en genes involucrados en la supresión de tumores
o en los mecanismos de reparación del ADN. Por ejemplo, la alteración
en el gen supresor de tumores denominado BCRA 1 (por Breast Cancer, en
inglés) se asocia a una mayor susceptibilidad a desarrollar cáncer
de mama y de ovario. La base de esta asociación se fundamenta en
que en el 45 por ciento de las familias con alta incidencia de cáncer
de mama existe una mutación en el gen BCRA 1, así como en
el 80 por ciento de las familias en las que se detectó cáncer
de ovario.
Un marcador de diagnóstico es el que indica la existencia de una
neoplasia o bien resulta de utilidad en la confirmación de un diagnóstico
histopatológico. Ejemplos de estos marcadores son la â-HCG
y la alfa-fetoproteína (á-FP) en cáncer de testículo
no-seminoma.
Por otra parte existen los marcadores de pronóstico, los cuales
permiten inferir, por un lado, la evolución clínica que
tendrá el paciente en términos de sobrevida global -que
es el tiempo total que vive una persona después del diagnóstico-,
y por el otro el tiempo libre de enfermedad, o sea el período que
transcurre entre el fin del tratamiento hasta que el tumor vuelve a aparecer
en el mismo sitio o en otro lugar. Por ejemplo, valores séricos
elevados del antígeno carcinoembrionario (CEA) son un indicador
de mal pronóstico en pacientes con cáncer colorrectal.
También se cuenta con marcadores predictivos, los cuales son útiles
para identificar a los pacientes con alta probabilidad de responder exitosamente
a algún tipo de tratamiento. Se ha establecido, por ejemplo, que
los pacientes con cáncer de próstata localizado que presentan
valores del antígeno prostático específico (PSA)
mayores a 7ng/ml (ng = nanogramo = 10-9g) tendrían menos probabilidad
de responder al tratamiento de radioterapia convencional. Por otro lado,
las pacientes con cáncer de mama que expresan receptores de estrógeno
y progesterona tienen más probabilidad de responder al tratamiento
hormonal antiestrógenos. Algunos marcadores son de pronóstico
y predictivos al mismo tiempo, porque aportan tanto información
sobre la evolución de la enfermedad como sobre la respuesta esperada
al tratamiento.
Existen también marcadores que permiten monitorear una enfermedad
en curso, o sea indicar el estado de la enfermedad de un paciente en un
momento dado. Mediante estos marcadores de seguimiento se puede estudiar
la evolución del paciente una vez que este ha finalizado su tratamiento,
anticipando una recidiva o detectando una patología mínima
residual. Por ejemplo, el marcador denominado CA 15-3, que será
explicado más adelante, predice con una antelación de seis
a nueve meses la recaída en pacientes con cáncer de mama.
Desarrollo de marcadores: de la investigación
básica a la aplicación clínica
La eventual utilidad clínica de los marcadores biológicos
está relacionada con la posibilidad de proporcionar información
adicional a los métodos clínicos, radiológicos y
de laboratorio convencionales. El proceso del desarrollo de un marcador
tumoral, que comienza en el laboratorio de investigación y finaliza
en su aplicación en la población, es complejo. A partir
del conocimiento de algunos aspectos del comportamiento biológico
de los tumores malignos se evalúa la eventual utilidad de factores
producidos por las células tumorales, o por células vecinas
estimuladas por estas, como posibles marcadores tumorales. Luego de someter
a este potencial marcador a una serie de pruebas y contrapruebas, se llega
a la instancia clínica, en la que el biomarcador en ensayo deberá
ser contrastado con métodos tradicionales, y de esta manera demostrar
su verdadero valor práctico. Muchas veces se falla a este nivel,
ya que no se logran los resultados esperados al ser aplicados en humanos.
La utilidad de un marcador, en un determinado tipo de cáncer y
aplicando una metodología adecuada al objetivo buscado, se estima
a través del número de falsos positivos y de falsos negativos.
Las características a evaluar son las siguientes:
Especificidad: un marcador tumoral específico tiene pocos falsos
positivos, o sea personas sin enfermedad con niveles elevados del mismo.
Sensibilidad: se estima como el porcentaje de pacientes con enfermedad
que presentan valores elevados del marcador (positivos verdaderos). El
marcador debe, además, presentar muy pocos falsos negativos, o
sea pacientes enfermos con niveles normales o bajos del mismo.
El cáncer de origen primario desconocido se presenta en un 5 a
10 por ciento de los pacientes oncológicos. Se trata de una población
heterogénea, dado que comprende numerosas formas clínicas
y diversas variedades histológicas, siendo lo más común
el diagnóstico de metástasis de un adenocarcinoma. En estos
casos se evalúan en el tejido la expresión de marcadores
de estirpe o linaje celular y marcadores de diferenciación celular
(tabla 1), además del dosaje de algunos marcadores
circulantes (tabla 2).
| TUMOR
A IDENTIFICAR |
MARCADORES
TISULARES |
| Linfoma |
| Cáncer
de próstata |
|
Cáncer folicular de
tiroides |
| Cáncer
medular de tiroides |
| Carcinoma
neuroendocrino |
| Tumor de células
germinales |
| Cáncer
de mama |
| Melanoma |
| Rabdomiosarcoma |
Angiosarcoma |
Tumor neuroectodérmico
periférico |
|
Tumores de estirpe epitelial |
|
| Antígeno común leucocitario |
| PSA |
| Tiroglobulina |
| Calcitonina |
| Sinaptofisina |
| Enolasa neuroespecífica |
| Cromogranina A |
| ß-HCG |
| a-FP |
| Fosfatasa
Alcalina Placentaria |
| Receptor estrogénico
|
| Receptor progesterona |
| S-100 |
| HMB 45 |
| Vimentina |
| Vimentina |
| Desmina |
| Actina
específica de músculo |
| Mioglobina |
| Vimentina |
| Factor VIII |
| Vimentina |
| Antígeno
013 (CD 99) |
| Citoqueratinas |
|
La valoración de la información aportada
por el panel de marcadores evaluados permitirá el diagnóstico
del tipo tumoral y el esquema terapéutico a implementar. La conclusión
definitiva respecto de cada biomarcador en particular surgirá del
análisis multidisciplinario, incluyendo los campos biológico,
clínico y epidemiológico.
Describiremos algunos marcadores que se detectan en la sangre mediante
la aplicación de distintos métodos bioquímicos, y
que mostraron una utilidad concreta cuando se utilizaron en la clínica
oncológica.
• Antigeno prostático específico. (PSA,
por sus siglas en inglés)
Es una glicoproteína -o sea una proteína unida a azúcares-
producida por las células del epitelio glandular de la próstata,
que presenta actividad enzimática y es responsable de la licuefacción
del líquido seminal.
La mayor limitación del PSA es ser tejido-específico y no
cáncer-específico, ya que se encuentra aumentado en cáncer
de próstata, pero también en otras condiciones tales como
infecciones y/o inflamaciones -prostatitis-, retención urinaria,
procedimientos que se llevan a cabo para evaluar el estado de la vejiga
-como la citoscopía o la colocación de sondas urinarias-
y en la biopsia prostática. En todos estos casos se debe esperar
al menos seis semanas para efectuar la medición de PSA. Además,
una droga utilizada para el tratamiento de la hiperplasia prostática
benigna, el Finasteride, puede causar una falsa disminución del
PSA en hasta un 50 por ciento, incluso hasta meses después de concluida
la terapia.
Los niveles de referencia del PSA dependen de la edad del paciente. Los
pacientes ancianos suelen tener niveles mayores de PSA por la alta prevalencia
de la hiperplasia prostática benigna. Así, mientras en los
varones de 40 a 50 años se consideran normales valores de hasta
2,5 ng/ml, en aquellos de más de 70 años se acepta una concentración
de PSA del orden de 5,5 ng/ml.
Tradicionalmente se considera que 4 ng/ml de PSA es el límite superior
normal -sin tener en cuenta la edad- y que los valores mayores a 10 ng/ml
son en general indicadores de la necesidad de una biopsia, la cual depende
también de los deseos del paciente, de la expectativa de vida y
de los factores de riesgo. Tampoco hay que olvidar que un 20 por ciento
de los pacientes con cáncer de próstata tiene un PSA menor
a 4 ng/ml y que sólo uno de cada cuatro pacientes con PSA entre
4 y 10 ng/ml tiene cáncer.
El PSA circula en sangre unido a inhibidores de proteasas, tales como
la alfa-1-antiquimotripsina y la alfa-2-macroglobulina, por lo que sólo
una pequeña fracción está libre. Los ensayos actuales
permiten cuantificar el PSA libre y el unido a la proteína y establecer
así la relación PSA libre/PSA total. La utilidad clínica
de esta determinación no está aún bien establecida,
pero se cree que servirá para discernir entre la necesidad o no
de biopsia en pacientes con PSA en el rango de 4 a 10 ng/ml y tacto rectal
normal.
El valor predictivo positivo para cáncer -o sea la posibilidad
de que un individuo con un test positivo presente la enfermedad- de un
PSA anormal es de un 42 por ciento, y al combinarlo con el tacto digital
rectal aumenta hasta un 60 por ciento. Se recomienda efectuar ambos exámenes
para la detección temprana en pacientes de riesgo.
El PSA puede servir también como factor pronóstico, asociado
a otros parámetros. Es la herramienta más útil para
la detección de una recaída luego de un tratamiento con
intención curativa. El PSA luego de una prostatectomía radical
debe disminuir progresivamente hasta 0 ng/ml, mientras que luego de la
radioterapia los niveles declinan gradualmente durante 1 a 2 años,
llegando en general a estabilizarse en valores inferiores a 1 ng/ml.
• Alfa-fetoproteína (á-FP)
Es una glicoproteína producida en el hígado, en el tracto
gastrointestinal y en el saco embrionario fetal. Se encuentra elevada
en el cáncer germinal no-seminoma del varón y no-disgerminoma
de la mujer, carcinoma hepatocelular y tumores gastrointestinales. En
pacientes con tumor de testículo con histologia de seminoma puro,
la elevación de este marcador hace pensar que existe además
un componente de no-seminoma en el tumor que no fue visto en el microscopio.
La concentración plasmática de á-FP también
es elevada cuando existe daño hepático producido, por ejemplo,
por ciertas drogas, tóxicos o alcohol. La mayor utilidad de la
determinación de á-FP se encuentra en la estadificación,
respuesta al tratamiento y seguimiento de pacientes con cáncer
de células germinales. Un 10 a 20 por ciento de los pacientes con
tumores no-seminoma estadio I, 20 a 40 por ciento de los estadios II y
40 a 60 por ciento de pacientes con metástasis poseen elevadas
concentraciones del marcador.
l Subunidad beta de la gonadotrofina coriónica de origen humano
(â-HCG)
Como su nombre lo indica, es una de las dos subunidades de una glicoproteína
producida por las células coriónicas. Se encuentra elevada
en los tumores germinales no-seminoma y no-disgerminoma -especialmente
en la variedad corioncarcinoma-, en tumores placentarios y en cáncer
avanzado de estómago. Su utilidad mayor se encuentra en la estadificación,
respuesta al tratamiento y seguimiento de pacientes con cáncer
de células germinales y tumores placentarios. En un 10 a 20 por
ciento de pacientes con tumor no-seminoma estadio I, 20 a 30 por ciento
estadio II y 40 a 60 por ciento de pacientes con metástasis, y
en un 15 a 25 por ciento de pacientes con seminoma diseminado se detectan
concentraciones anómalas del marcador.
Otros marcadores de alta utilidad son la adrenalina, noradrenalina y sus
metabolitos urinarios en el feocromocitoma, un tumor de la glándula
suprarrenal. La serotonina y metabolitos derivados están elevados
en tumores carcinoides, los cuales constituyen un grupo de tumores que
se localizan en distintas regiones del cuerpo y se caracterizan por liberar
sustancias que ocasionan síntomas como diarrea, sofocones, enrojecimiento
de la piel, presión alta, etc. También son marcadores de
uso corriente la tiroglobulina en el cáncer folicular de tiroides
y la calcitonina en el cáncer medular de tiroides.
Marcadores de moderada utilidad
l El antígeno carcinoembrionario (CEA por sus siglas en inglés)
El CEA es también una glicoproteína, emparentada con las
inmunoglobulinas por sus características estructurales. Se la encuentra
muy concentrada en el propio tejido tumoral, pero escasamente elevada
en suero. Los niveles séricos de CEA están elevados en tumores
gastrointestinales, mamarios y pulmonares, y en condiciones no malignas
como obstrucción biliar, hepatitis subclínica, enfermedad
inflamatoria intestinal, cirrosis alcohólica y bronquitis crónica.
Se ha observado también que el CEA está elevado en un 50
por ciento en las personas que fuman.
Este marcador es útil solamente en los casos de cáncer colorrectal.
Los niveles de CEA tienden a aumentar con el estadio, pero los tumores
poco diferenciados pueden no secretar CEA. Un 80 por ciento de los pacientes
con enfermedad metastásica tienen CEA elevado, pero sólo
un 49 a 53 por ciento de los que tienen enfermedad localizada. Un nivel
preoperatorio elevado de CEA implica un mal pronóstico, y una falla
en la normalización de los niveles de 4 a 6 semanas después
de la cirugía refleja persistencia de enfermedad. Pero los niveles
de CEA como único marcador no se utilizan para determinar la conducta
terapéutica, y la utilidad como marcador de recaída en el
seguimiento permanece controvertida. Si bien las recurrencias asintomáticas
tienen mejor sobrevida que las sintomáticas, menos del dos por
ciento de las recurrencias de cáncer colorrectal presenta un CEA
elevado como único indicador de enfermedad.
• Antígeno carbohidrato 125 (CA 125)
Es una glicoproteína producida por derivados del epitelio
celómico -pleura, pericardio, peritoneo, trompa de Falopio, endometrio
y endocérvix-. Como antígeno de superficie se expresa en
el 80 por ciento de los tumores no-germinales de ovario -variedad epitelial
no-mucinoso-. Algunos de estos lo liberan a circulación, donde
tiene una vida media de cuatro a cinco días. Altos niveles de CA
125 –90 por ciento de estadios III o IV y 50 por ciento en estadios
I- se asocian a un mal pronóstico. Las pacientes con estadios I
y altos niveles de CA 125 (65 UI/ml) son candidatas a quimioterapia postoperatoria
antes que a vigilancia. El CA 125 también se encuentra elevado
en otras patologías tales como endometriosis, endometritis y tumores
intraabdominales de cualquier estirpe.
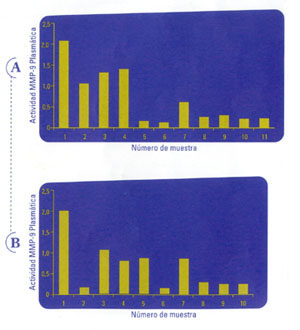 Figuras 1 A (Carcinoma ductal infiltrante, estadio IIIA) y 1 B (Carcinoma
ductal infiltrante, estadio IIA). Se ejemplifica la
situación de dos pacientes que comienzan a estudiarse con valores
elevados de MMP-9. Luego de la remoción quirúrgica del tumor
primario y de desarrollar una respuesta completa a las terapias adyuvantes,
se observa un descenso progresivo en la actividad MMP-9 circulante. Actualmente,
estas pacientes se encuentran sin enfermedad y con valores bajos de actividad
MMP-9 en plasma.
Figuras 1 A (Carcinoma ductal infiltrante, estadio IIIA) y 1 B (Carcinoma
ductal infiltrante, estadio IIA). Se ejemplifica la
situación de dos pacientes que comienzan a estudiarse con valores
elevados de MMP-9. Luego de la remoción quirúrgica del tumor
primario y de desarrollar una respuesta completa a las terapias adyuvantes,
se observa un descenso progresivo en la actividad MMP-9 circulante. Actualmente,
estas pacientes se encuentran sin enfermedad y con valores bajos de actividad
MMP-9 en plasma.
Marcadores de escasa utilidad clínica
• Antígeno asociado a cáncer 15-3 (CA 15-3)
Aproximadamente un 55 por ciento de las pacientes con cáncer de
mama metastásico presenta concentraciones elevadas de este marcador.
Pero también se lo encuentra en altos niveles en casos de hepatitis
aguda y crónica activas, enfermedades benignas intestinales y en
el 20 por ciento de las enfermedades benignas de la mama, lo que impide
su utilización como método de detección. Si bien
el CA 15-3 permite predecir con seis a nueve meses de antelación
una recaída, la ausencia de terapia específica para enfermedad
no evidente por otro método -radiografías, tomografías,
etc.- hace que pierda utilidad como método de seguimiento.
• Antígeno carbohidrato 19-9 (CA 19-9)
Se trata de una glicoproteína presente en la superficie celular,
elevada en pacientes con tumores gástricos y cáncer de páncreas.
Se relaciona con el volumen tumoral y es un factor pronóstico en
estos tumores. No es útil como método de detección
de cáncer pancreático, pero puede ayudar a distinguir este
proceso de la pancreatitis, a pesar de que se encuentra elevado en el
30 por ciento de las pancreatitis crónicas y en el 20 por ciento
de las agudas.
• Fosfatasa alcalina (FAL)
Es un marcador de actividad tumoral y factor pronóstico en pacientes
con osteosarcoma, un 45 por ciento de los cuales presentan concentraciones
altas de este marcador. Sin embargo, no resultó de utilidad en
el manejo terapéutico.
Propuesta de un marcador para cáncer
de mama:
El cáncer de mama es la neoplasia más frecuente en los países
occidentales, en los cuales: se estima que el 10 por ciento de las mujeres
desarrollará esta patología en algún momento de su
vida. En la Argentina, el cáncer de mama ocupa el primer lugar
entre las causas de muerte por cáncer en la mujer adulta.
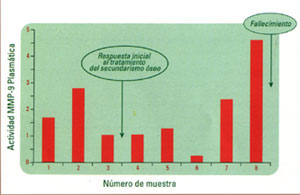
figura 2
Esta paciente comienza a estudiarse con diagnóstico de metástasis
óseas a partir de su tumor primario de mama y niveles elevados
de actividad MMP-9 circulante. Inicialmente responde a los tratamientos
implementados coincidiendo con un descenso de la actividad enzimática.
Posteriormente, ante la progresión de la enfermedad se evidencia
un incremento de actividad MMP-9 plasmática que se mantiene de
este modo hasta el fallecimiento de la paciente.
Es importante disponer de indicadores que permitan predecir cómo
una paciente va a responder a determinado tratamiento antes de que éste
se le administre. Esto posibilitaría la selección del tratamiento
más adecuado para cada paciente, o sea la clase de cirugía
y la terapia posterior.
En el caso de las pacientes con cáncer de mama, el tamaño
tumoral y la presencia de ganglios linfáticos axilares positivos
para metástasis -detectados en el momento de efectuar el diagnóstico
de carcinoma primario de mama-, son los principales factores con valor
pronóstico desde el punto de vista clínico. Recordemos,
además, que el hallazgo de metástasis a distancia ensombrece
el pronóstico, dado que nos está indicando un diagnóstico
en estadio avanzado de la enfermedad. Posteriormente, cuando la pieza
quirúrgica se envía a patología para su análisis,
la determinación del grado histológico de malignidad, los
marcadores de proliferación celular estudiados en el tejido y la
expresión de receptores para estrógeno y progesterona, constituyen
también importantes indicadores de pronóstico y de cómo
la paciente puede llegar a responder a algunos tratamientos -son los marcadores
predictivos-. Así, por ejemplo, la presencia de los receptores
mencionados en el tejido evaluado indicarán la posibilidad de aplicar
una terapia antihormonal postcirugía.
Es de particular interés la descripción de factores circulantes
que posibiliten realizar el seguimiento de la paciente. La obtención
de una muestra de sangre o de orina, por ejemplo, implica un procedimiento
poco invasivo y traumático. O sea, que se busca que el nivel circulante
de ese factor, medido con determinada periodicidad, proporcione información
con respecto a la respuesta del paciente al tratamiento que recibe y,
una vez concluido el mismo, permita anticiparse a la progresión
de la enfermedad.
En el Instituto de Oncología ‘Angel H Roffo’ se desarrolló
un método original, sensible y específico, denominado zimografía
cuantitativa, que permite dosar la actividad de una metaloproteasa en
el plasma (véase el recuadro ‘Características de la
MMP-9’). La metaloproteasa número 9 (MMP-9) es una enzima
que destruye la gelatina –un componente de la matriz extracelular-,
por lo que forma parte de las gelatinasas. El ensayo consiste en realizar
una reacción química usando gelatina, sobre la cual se ponen
las muestras de plasma de las pacientes. Para que la reacción se
produzca hay que ajustar las condiciones físicas y químicas
para que se parezcan a las fisiológicas –37 °C de temperatura
y pH 7.4-. Luego de 20 horas la gelatina se tiñe empleando un colorante.
Se observarán bandas translúcidas -no teñidas- correspondientes
a las zonas en las cuales la enzima degradó la gelatina. La cuantificación
de las bandas de actividad se realiza por densitometría, utilizando
un programa de computación especial para este tipo de análisis.
Se ha hallado que la actividad plasmática de MMP-9 se encuentra
aumentada en pacientes con cáncer de mama con respecto a aquellas
con patologías mamarias benignas y a un grupo de mujeres sanas.
Analizamos el comportamiento de la actividad MMP-9 plasmática en
estas pacientes, luego de la remoción quirúrgica de su tumor
primario, durante la terapia adyuvante -radioterapia, quimioterapia, hormonoterapia,
o las distintas combinaciones de estas monoterapias- y una vez concluido
la misma.
Se estudiaron 60 pacientes con cáncer de mama, cuya evolución
se siguió a lo largo de cinco años, tomándose muestras
de sangre cada tres meses. En aquellas pacientes que desarrollaron una
respuesta completa al tratamiento -44 casos sobre 60-, se observó
una disminución progresiva de los niveles de actividad MMP-9 circulante
(figuras 1A y 1B). Al mismo tiempo se determinó que en 16 casos
de los 60 estudiados el incremento de la actividad acompañó
el diagnóstico de enfermedad en progresión (figuras 2 y
3). En todos ellos el aumento pudo detectarse con un periodo de anticipación
que osciló entre uno y ocho meses, con respecto al diagnóstico
clínico.
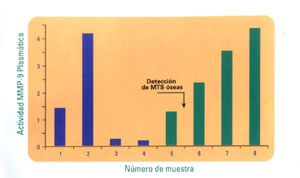
figura 3 Se
muestra el caso de una paciente con carcinoma ductal infiltrante, estadio
IIIB, que comienza a estudiarse con valores elevados de actividad MMP-9.
Luego del tratamiento inicial estos niveles de actividad descienden, coincidiendo
con un periodo libre de enfermedad. Posteriormente, se determina un aumento
en la actividad circulante de MMP-9, cinco meses antes de realizarse el
diagnóstico clinico de metástasis óseas.
Se considera que la actividad de MMP-9 circulante,
refleja la situación clínica en la que se encuentra cada
paciente, en el 100 por ciento de los casos seguidos hasta el presente.
Es decir que la cuantificación de la actividad de MMP-9 en pacientes
con cáncer de mama resulta de utilidad en el monitoreo de la respuesta
al tratamiento y en el seguimiento de la evolución de la enfermedad
tras haber completado el mismo.
| Características
de la MMP-9 |
| La MMP-9 pertenece a una amplia familia de enzimas denominada metaloproteasas
o MMPs. El prefijo 'metalo' significa que para actuar necesitan de
uno o más metales, en este caso el zinc -en el sitio activo-
y calcio en el medio de reacción. Es una enzima que puede degradar
distintos componente de las matrices extracelulares, en particular
el colágeno tipo IV, principal constituyentes de las membranas
basales de los epitelios y de los vasos sanguíneos y linfáticos.
Participa en múltiples procesos fisiológicos normales
que implican la reparación y la remodelación tisular.
Se encuentra aumentada en procesos inflamatorios agudos y crónicos
-artritis reumatoidea, artrosis, etc.-, cicatrización y en
enfermedades degenerativas del sistema nervioso central. Tanto en
animales de laboratorio como en pacientes se ha detectado un incremento
significativo en la expresión de esta proteasa en diversos
tumores malignos. Hemos determinado en nuestro laboratorio que la
actividad MMP-9 circulante se encuentra significativamente elevada
en el plasma de pacientes con cáncer de mama, de cabeza y de
cuello. Es necesario profundizar las investigaciones con respecto
al significado biológico de este incremento, con el propósito
de determinar la utilidad en la práctica clínica de
la MMP-9 como marcador de pronóstico y seguimiento del paciente. |
Stella Maris Ranuncolo: Médica (UBA). Becaria
de Perfeccionamiento (CONICET). Profesional investigador. Instituto de
Oncología ‘Angel Roffo’ (UBA). Jefe de Trabajos Prácticos,
Departamento de Histología y Biología Celular, III Unidad
Académica, Facultad de Medicina (UBA).
Leandro Cerchietti: Médico (Universidad del Salvador). Especialista
en Oncología Clínica (Universidad Católica Argentina).
Profesional investigador. Instituto de Oncología ‘Angel Roffo’
(UBA). Docente de Fisiología y Biofísica, Facultad de Medicina
(Universidad del Salvador).
Lecturas sugeridas:
• BIOMARKERS AD-HOC, Group of the United Kigdom Coordinating Comité
on Cancer Research, 2000, ‘Biological markers: maintaining standards’,
British Journal of Cancer, 82:10, 1627-1628.
• 2000, ‘Can biological markers improve the management of
breast cancer patients?’, British Journal of Cancer, 82-10, 1625-1626.
• GÓMEZ DE Y ALONSO DF, 1998, Introducción a la oncología
molecular, 1ª. Ed., Editorial de la Universidad Nacional de Quilmes.
• GORDON JS, 2000, ‘circulating tumor markers’, en De
Vita, Rosemberg and Hellman, Principles and Practice of Oncology, 303-314.
• GREM J, 1997, ‘The pronostic importance of tumor markers
in adenocarcinomas of the gastrointestinal tract’, Current Opinion
in Oncology, 9:380-387.
• En la Web: www.latincancer.org
Por cuestiones de espacio se han extraído del artículo
las Tablas I y II y el glosario que pueden consultarse en el artículo
original.
|