- Amoxicilina
(20ug) Acido Clavulánico (10ug).
- Ceftazidima (30ug) Acido Clavulánico (10ug).
- Cefotaxima (30ug) Acido Clavulánico (10ug).
Fundamento
El principio de acción del producto, se basa en la combinación
de un antibiótico Beta Lactámico con un inhibidor de enzimas
beta lactamasas (Acido Clavulánico).
Los antibióticos beta lactámicos, se unen a las proteinas
ligadoras de Penicilina e inhiben la síntesis del peptidoglicano
y por ende, inhiben la síntesis de la pared celular bacteriana.
Son antibióticos bactericidas y se usan comúnmente en la
terapéutica de infecciones a bacilos Gram negativos.
Uno de los mecanismos de resistencia a los antibióticos beta lactámicos
es por la presencia de enzimas beta lactamasas adquiridas, que se encuentran
generalmente codificadas en elementos móviles (plásmidos,
transposones, integrones) e hidrolizan el enlace amida del anillo beta
lactámico originando derivados ácidos sin actividad antibacteriana.
Su localización en elementos móviles, les permite ser transferidas
entre bacterias del mismo o diferente género y especie, lo que
hace muy importante y necesaria su correcta detección debido a
los brotes nosocomiales (sobretodo en unidades de terapia intensiva) y
además porque la emergencia de bacterias productoras de enzimas
beta lactamasas impide la continuidad del tratamiento con antibióticos
beta lactámicos por fallas terapéuticas.
Según el perfil de sustratos que hidrolizan, estas enzimas pueden
clasificarse en dos grupos: I) Beta Lactamasas de espectro ampliado: actúan
sobre Penicilinas y Cefalosporinas
de primera generación. Ejemplos de estas enzimas son TEM-1, TEM-2
y SHV-1 que son las mas comúnmente distribuidas en bacilos Gram
negativos.
II) Beta Lactamasas de Espectro Extendido: BLEE: actúan sobre Penicilinas,
Cefalosporinas de primera, segunda, tercera y cuarta generación,
y monobactames. Escapan a su acción las Cefamicinas (Cefoxitina,Cefotetán)
y los Carbapenemes. En EEUU y Europa, estas enzimas suelen ser derivadas
de las beta lactamasas de espectro ampliado mas comunes y son consecuencia
de unas pocas mutaciones sobre los genes que las codifican, mientras que
en Argentina la BLEE prevalente es CTX-M-2 que es una fuerte cefotaximasa
y tiene poca actividad sobre Ceftazidima y Aztreonam, y otra BLEE menos
frecuente hallada es PER-2 que tiene fuerte actividad Ceftazidimasa.
La detección de laboratorio, puede ser problemática porque
algunas BLEE tienen distintos niveles de actividad frente a las distintas
Penicilinas y Cefalosporinas, y pueden aparecer sensibles en los tests
de sensibilidad in vitro a los antimicrobianos.
Para detectar la presencia de estas enzimas, hay métodos
de biología molecular y microbiológicos:
- Métodos de biología molecular: tienen sensibilidad variable,
pueden demandar bastante tiempo, son costosos y técnicamente dificultosos
para desarrollar (requieren equipamiento
especial y experiencia).En Argentina, el acceso de la mayoría de
los hospitales a métodos moleculares es limitado.
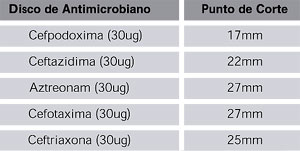
Métodos microbiológicos: la NCCLS* proporcionó
nuevas recomendaciones con respecto a los puntos de corte a utilizar en
la deteccion de BLEE en Escherichia coli, Klebsiella pneumoniae y Klebsiella
oxytoca, y los antimicrobianos recomendados son: Cefotaxima (30ug), Ceftriaxona
(30ug), Ceftazidima (30ug), Cefpodoxima (10ug), y Aztreonam (30ug) (cuantos
mas antimicrobianos se utilicen en el antibiograma, mayor será
la probabilidad de detectar cepas productoras de bajos niveles de BLEE).
Ver cuadro 1
a) Doble Difusión de Discos: Se
coloca un disco de antibiótico Beta Lactámico y un disco
de inhibidor de enzimas Beta Lactamasas a una distancia de 20-30mm entre
los centros de ambos discos. Un test positivo es por observación
del "Efecto Huevo", que es el agrandamiento de la zona de inhibición
del desarrollo alrededor de la Penicilina o Cefalosporina hacia el disco
de amoxicilina (20ug) +ácido clavulánico (10ug).
Este método requiere un cuidado especial en la distancia de colocación
de los discos ya que sino se puede afectar la visualización. Además
debe utilizarse una placa extra.
b) Método Confirmatorio por discos:
éste es el método que presentamos para detectar BLEE y que
fue recomendado por NCCLS* a partir del año 1999":
Se colocan en el antibiograma dos pares de discos: Ceftazidima (30ug),
Cefotaxima (30ug), Ceftazidima (30ug) + Acido Clavulánico (10ug)
y Cefotaxima (30ug) + Acido Clavulánico (10ug).
La presencia de BLEE se evidenciará como una diferencia mayor o
igual a 5mm entre el halo de inhibición del disco de Ceftazidima-Acido
Clavulánico con respecto al de Ceftazidima, y como una diferencia
mayor o igual a 5mm entre el halo de inhibición del disco de Cefotaxima-Acido
Clavulánico con respecto al de Cefotaxima.
Este es un método fácil, rápido y reproducible para
la detección de BLEE, además es adecuado para su uso en
pruebas de rutina, ya que se utiliza la misma metodología que la
indicada para la prueba de sensibilidad a los antimicrobianos, y esto
permite hacer posible el screening de todos los aislamientos durante las
pruebas de sensibilidad.
Metodología: “Método de Difusión
en Agar Mueller Hinton según normas NCCLS*”:
a- Preparación de las placas con el medio de cultivo
-Medio: el medio a utilizar es el Agar Mueller Hinton. Debe controlarse
que el pH del mismo se encuentre entre 7.2 y 7.4.
-Volumen del medio por placa: debe verterse 25 a 30 ml. de agar fundido
y enfriado a 50-55 ºC en placas estériles de vidrio o plástico,
de modo de obtener una capa de 4mm de alto. Es fundamental respetar esta
condición, pues de lo contrario, se obtendrán halos mayores
o menores según el caso.
-Secado de las placas: para eliminar la humedad sobre la superficie del
medio, las placas deben secarse incubándolas a 35-37 ºC durante
30-60 minutos.
b- Muestra
- Condiciones de los cultivos originales: es necesario que el antibiograma
se realice a partir de cultivos monomicrobianos, o cuando menos, con colonias
bien separadas del mismo aspecto de la placa de aislamiento. No tiene
sentido efectuar antibiogramas con materiales directos que segura o potencialmente,
contengan flora polimicrobiana (exudados faríngeos, nasales, orina,
heces, etc.). Debe tenerse en cuenta que el método de Bauer y Kirby
se aplica a bacilos Gram negativos de fácil desarrollo (Enterobacteriaceae,
Pseudomonas spp.), Staphylococcus spp. y Enterococcus spp., no pudiendo
ser utilizado sin modificaciones para determinar la susceptibilidad in
vitro frente a otros gérmenes. Las pruebas de difusión por
el método de los discos para H. influenzae, N. gonorrhoeae y S.
pneumoniae se deben realizar de acuerdo a las normas NCCLS* vol. 24 Nº
1 (2004) Documento M2- A8.Otras bacterias fastidiosas, se pueden ensayar
por el método de dilución de acuerdo a las normas NCCLS*
vol. 23 Nº 2 (2003) Documento M7-A6.
- Preparación del inóculo: se toman de 3 a 5 colonias del
cultivo original con un ansa de nichrome y se introducen en 5 ml. de caldo
tripteina soja. Si la suspensión obtenida tiene
una turbidez superior o similar al testigo no es necesario una incubación
ulterior. De lo contrario, los tubos se incuban a 35-37 ºC hasta
lograrse la turbidez requerida. En ambos casos si es necesario, diluir
para equiparar la suspensión a la del testigo; puede utilizarse
para ello, caldo o solución salina. Para estafilococos y microorganismos
fastidiosos, puede usarse el método directo a partir de la colonia
aislada.
c- Siembra en Placas
La suspensión bacteriana obtenida como se indica previamente es
absorbida con un hisopo de algodón(no debe usarse ansa metálica
ni varilla de vidrio).El exceso de líquido se descarta oprimiendo
el algodón contra la pared del tubo.
Se inocula la superficie seca del Agar Mueller Hinton por hisopado en
tres direcciones rotando la placa 60 º cada vez, para asegurar una
completa distribución del inóculo. Se
dejan secar las placas de 3 a 5 minutos antes de proceder a aplicar los
discos.
d- Condiciones de los discos
Es necesario cumplir con los puntos escritos en precauciones. Es de fundamental
importancia tener en cuenta, que este método solo tiene valor si
se respeta una distancia que
separe los discos, suficientemente para limitar las probabilidades de
superposición importante de zonas de inhibición.
Por consiguiente, pueden aplicarse solamente 5-6 discos en una placa convencional
de 100 mm (la usada comunmente en nuestro medio).No es conveniente exceder
el número
máximo de discos por placa ya que, de lo contrario, los halos correspondientes
a la inhibición provocada por antibióticos, pueden interferir
con los de los discos vecinos, pudiendo ocurrir tanto sinergismos o antagonismos,
que no corresponden a la realidad.
e- Aplicación de los discos
Se aplican sobre la superficie del agar por medio de una pinza. Se debe
tener el cuidado que los discos hagan buen contacto con la superficie
del agar, ejerciendo para ello ligera presión sobre los mismos.
Incubación
Transcurridos 15 minutos de la aplicación de los discos, las placas
se incuban invertidas en la estufa a 35-37 ºC, en aerobiosis, durante
toda la noche (18hs). (Ver
cuadro 2)
Almacenamiento
Los discos deben estar convenientemente refrigerados y protegidos de un
exceso de humedad. La conservación se debe realizar entre -20 y
0 ºC para mantener su potencia.
La pequeña cantidad necesaria para el trabajo semanal o transporte
al usuario, puede mantenerse refrigerada entre 2 a 8 ºC, por un tiempo
no mayor de siete días.
Presentación
Por 50 discos:
Amoxicilina (20ug) Acido Clavulánico (10ug). Código: B11-399-27
Ceftazidima (30ug) Acido Clavulánico (10ug). Código: B11-383-27
Cefotaxima (30ug) Acido Clavulánico (10ug). Código: B11-384-27
* N.A.= No aplicable
* NCCLS. es actualmente C.L.S.I (Clinical Laboratory Standards Institute).
Nota: La presente información es
provista por Laboratorio Britania S.A. y es difundida con cargo de publicación.
|