Cómo se estudia el comportamiento de moléculas individuales
¿Se puede ver una molécula?
El Comité de Redacción de Acta Bioquímica Clínica Latinoamericana ha seleccionado este artículo publicado en CIENCIA HOY – Volumen 21 - Número 124 – agosto - septiembre 2011, para su difusión a través de FABA Informa

Fernando D Stefani y Pedro F Aramendía
Facultad de Ciencias Exactas y Naturales, UBA
¿DE QUÉ SE TRATA?
Ingeniosas técnicas para ‘ver’ lo que es demasiado pequeño para que el ojo humano lo distinga, aun con la ayuda de modernos microscopios ópticos.
Las moléculas constituyen las unidades fundamentales de la materia, están compuestas por dos o más átomos, y tienen tamaños y formas variables. Las de hidrógeno u otros gases simples están compuestas por dos átomos y miden algunas décimas de nanómetro (millonésimas de milímetro o 10-9m, nm). Macromoléculas como los polímeros orgánicos (por ejemplo, el polietileno) o muchas moléculas de seres vivos o biomoléculas (por ejemplo, las proteínas) están compuestas por miles de átomos y alcanzan tamaños de decenas de nanómetros.
Para el ser humano, ver las cosas constituye una de las evidencias más directas. Las moléculas tienen tamaños mucho menores de lo que puede distinguir el ojo humano, incluso con la ayuda de los mejores microscopios tradicionales. De hecho, la noción de molécula nació como un modelo conceptual de la realidad y no como una descripción de algo que se veía. Este concepto se estableció firmemente porque permitió explicar la estructura y las reacciones de los compuestos químicos.
¿Por qué no podemos ver las moléculas? La visión consiste en detectar la luz reflejada o dispersada por un objeto iluminado. Utilizando microscopios ópticos podemos ver objetos muy pequeños, pero su tamaño debe ser igual o mayor que la longitud de onda de la luz empleada para iluminarlos; si no es así, la dispersión de luz es invisible. Como la luz visible tiene longitudes de onda que van desde los 400nm (violeta) a los 700nm (rojo), todas las moléculas, incluso las más grandes macromoléculas, resultan invisibles para el ojo humano (ver el recuadro ‘Las moléculas y las radiaciones’).
Una manera de obtener información sobre la estructura molecular es usar radiación con longitudes de onda mucho menores (del orden del nanómetro, como los rayos X) y valerse de detectores de esa radiación que reemplacen al ojo humano. Experimentalmente esto es una tarea posible pero muy exigente, ya que se requieren miles de millones de moléculas idénticas (del orden de 1010), perfectamente ordenadas en un cristal y en condiciones de laboratorio muy cuidadas, para obtener una medición razonable.
Entonces, ¿cómo podemos analizar las características y la evolución de una sola molécula? Hoy existe un número de técnicas que permiten estudiar diversas propiedades de moléculas individuales. Por ejemplo, las microscopias de sondeo superficial permiten conocer la topografía (microscopia de fuerza atómica) o la distribución electrónica (microscopia de efecto túnel) de moléculas individuales. Claro que, por ser técnicas de sondeo superficial, quedan limitadas a moléculas adsorbidas, y en muchos casos inmovilizadas, sobre un sustrato (ver recuadro ‘las microscopias modernas: el sondeo molecular’).
En este artículo presentaremos otra familia de técnicas basadas en luz visible con capacidad de detectar y estudiar moléculas individuales, que pueden absorber luz. Los electrones de una molécula pueden tomar la energía de un fotón para pasar de su estado fundamental (un orbital de mínima energía) a estados excitados (orbital de mayor energía). Esos electrones excitados pueden regresar a su estado fundamental y liberar esa energía extra mediante la emisión de luz. Este proceso de emisión de luz se denomina fluorescencia molecular. El recuadro ‘las moléculas y las radiaciones’ explica algunos conceptos básicos sobre el tema y la figura 1 (izquierda) describe esquemáticamente el proceso.
Un aspecto clave de la fluorescencia es que en el lapso entre la absorción y la emisión de luz, la molécula puede perder parte de la energía mediante otros mecanismos, por ejemplo, mediante interacciones con un solvente o medio que la rodee. La energía del fotón absorbido es siempre mayor que la del fotón emitido, lo que implica que la longitud de onda de la luz absorbida es siempre menor que la de la luz emitida. Experimentalmente, esta diferencia de colores entre la luz absorbida y la emitida permite separar ambas luces mediante filtros de color, y detectar con gran sensibilidad la emisión, hasta el punto de poder acusar la luz emitida por una sola molécula. En este artículo explicaremos cómo, a pesar de no poder ver una molécula en el sentido estricto, el hecho de que podemos descubrir la luz emitida por ella permite obtener valiosa información científica. La detección y espectroscopia de moléculas individuales basadas en fluorescencia comenzó hace unos veinte años con los trabajos pioneros de William E Moerner, de la Universidad de Stanford. Michel Orrit, de la Universidad de Leiden, y Richard A Keller, del Laboratorio Nacional de Los Álamos, entre otros.
Una de las posibilidades más útiles que nos ofrece la detección de moléculas únicas es poder conocer la ubicación molecular y seguir la señal molecular en el tiempo. En materia experimental, además de tener detectores de luz muy sensibles, que sean capaces de revelar la pequeña cantidad de luz emitida por una sola molécula, es necesario tener en cuenta otros dos importantes factores.
Primero, la molécula de interés debe encontrarse sola, es decir, debe ser la única fuente de luz dominante. Imaginemos como analogía que en lugar de una molécula que emite luz queremos detectar una luciérnaga en la oscuridad de la noche. Al igual que la molécula, la luciérnaga misma no puede verse, pero se puede divisar la luz que emite. Todos sabemos que la presencia de muchas luciérnagas dificulta establecer y seguir la posición de una en particular. Lo mismo sucede con un cielo muy estrellado. De igual forma, para detectar una molécula individual mediante fluorescencia se requiere que esta se encuentre suficientemente separada de otras de su especie (figura 1, centro) .Además, dado que las moléculas que emiten una señal se encuentran inmersas en un medio sólido o liquido, es condición necesaria que los millones de moléculas que integran ese medio no contribuyan a la señal.
En segundo lugar, hay que considerar los tiempos. Imaginemos que queremos seguir la trayectoria de vuelo de una luciérnaga en la oscuridad. Las luciérnagas se mueven rápido y la luz que emiten es intermitente en intervalos de segundos. Esa intermitencia nos impide conocer la trayectoria completa de la luciérnaga, pero no nos impide usar a las luciérnagas para medir trayectorias más lentas. Por ejemplo, si nos ingeniáramos para fijar una luciérnaga en el lomo de una tortuga, podríamos usar la luz de la luciérnaga para determinar con gran precisión la trayectoria de una tortuga en la oscuridad. De manera análoga, cuando se trabaja con moléculas individuales es necesario hacer un balance temporal para asegurarse de que los tiempos que se quieren medir sean compatibles con los tiempos del proceso de fluorescencia. Esto se entiende más claramente si se piensa que una molécula excitada por la absorción de un fotón necesita cierto tiempo para estar en condiciones de emitir un fotón de fluorescencia y quedar lista para ser nuevamente excitada. Ese tiempo de des excitación está en el orden de uno a diez nanosegundos, e impone un límite a la intensidad de luz emitida y, en consecuencia, también a los tiempos necesarios para la detección de moléculas individuales. Además, la emisión de fluorescencia de moléculas individuales presenta otras intermitencias más prolongadas, debido a diversos procesos fisico-químicos (por ejemplo, excursiones a estados moleculares no emisores de luz).
Teniendo la debida consideración por estos factores, es posible ‘ver’ moléculas individuales en acción. ¿Qué información adicional o única se obtiene mediante mediciones de esas moléculas? A responder esta pregunta se dedican las secciones siguientes.
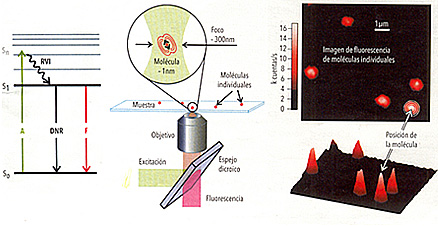
• Figura 1. Izquierda. Descripción esquemática de los pasos del proceso de fluorescencia molecular. Excitación desde el estado fundamental So a uno excitado Sn por absorción de un fotón (A). Mediante relajación vibracional intramolecular (RVI) la molécula queda en el estado excitado S1, del que regresa al So sea por decaimiento no radiactivo (DNR) o emitiendo un fotón de fluorescencia (F).
Centro. Arreglo usual para la detección de fluorescencia de moléculas individuales.
Derecha. Imagen y gráfico superficial de la fluorescencia de moléculas individuales. El tamaño de las señales está dado por la resolución del sistema óptico, típicamente 200 -400nm, pero la posición de las moléculas puede determinarse con mucha mayor precisión ajustando las señales y determinando su centro.
LAS MOLÉCULAS Y LAS RADIACIONES
Una molécula es un conjunto espacialmente ordenado de átomos y constituye la unidad fundamental de la materia. Los átomos tienen núcleos formados por protones con carga eléctrica positiva, y neutrones, sin carga; además, tienen electrones, distribuidos alrededor del núcleo y con carga negativa. Los átomos resultan así eléctricamente neutros. En la molécula los electrones pueden tomar diversas configuraciones, en las que ocupan los llamados orbitales, que fijan su distribución espacial. En su configuración más estable, los electrones se ubican en los orbitales de menor energía. Los electrones pueden pasar a orbitales de mayor energía mediante algún proceso como, por ejemplo, excitación eléctrica, por choques o por absorción de radiación, que es lo que nos incumbe en este artículo.
Las radiaciones electromagnéticas -como la luz visible, la ultravioleta y la infrarroja, los rayos X y los rayos gama- son campos eléctricos y magnéticos que se propagan y oscilan de forma periódica con una frecuencia v. La longitud l de sus ondas es igual al cociente entre la velocidad de la luz (c) y la frecuencia de oscilación: l = c/v. Una de las propiedades de la radiación electromagnética, encontrada por Max Planck (1858-1947) a comienzos del siglo XX y luego tomada como una de las bases de la mecánica cuántica, es que esas radiaciones están formadas por cuasipartículas denominadas fotones, que transportan la energía electromagnética. La energía de un fotón está determinada por el producto de la frecuencia y la llamada constante de Planck (h): E = hv. En este contexto, la intensidad de la radiación se interpreta como un flujo de fotones.
En el proceso de absorción de luz, una molécula absorbe un fotón y, como consecuencia, un electrón molecular pasa a un orbital de mayor energía; se dice entonces que la molécula está excitada. Este proceso es aleatorio o estocástico, y su probabilidad aumenta cuando los fotones poseen exactamente la energía necesaria para mover electrones de un orbital de baja energía a uno de mayor energía. Si un fotón no tiene suficiente energía, no puede producir la transición del electrón, pero tampoco lo hace si la tiene en exceso. Por otro lado, cuanto mayor es la intensidad de la luz, mayor es la probabilidad de excitación de la molécula, simplemente porque hay más fotones que pueden ser absorbidos por ella.
¿Cómo retorna una molécula excitada a su estado fundamental?
Una molécula excitada puede liberar la energía adquirida por la absorción de un fotón mediante diversos procesos. Los más comunes son: (i) mediante colisiones con otras moléculas que estén su alrededor, y (ii) emitiendo otro fotón, siempre de menor energía, es decir, de diferente frecuencia o color, que el fotón absorbido. Este último mecanismo corresponde al fenómeno que se denomina fluorescencia y está ilustrado en la figura 1 (izquierda). La fluorescencia es algo frecuente en la vida cotidiana: por ejemplo, las aguas tónicas, que contienen quinina, adquieren por esta razón un aura azulina cuando son iluminadas por luz ultravioleta y lo mismo hacen las marcas agregadas a los billetes de banco para garantizar su autenticidad.
|
Más allá del promedio: obtención de distribuciones estadísticas
Las mediciones químicas tradicionales se realizan con muestras macroscópicas de un material, las cuales contienen un número enorme de moléculas. Como resultado se obtiene un valor de la propiedad medida que es el promedio de los valores de esa propiedad en cada una de las moléculas de la muestra. Las investigaciones de moléculas individuales dan acceso a la distribución estadística de esos valores, es decir, indican cuántas moléculas tenemos con cada magnitud de la variable medida, algo particularmente importante en sistemas complejos o heterogéneos, en los que existe una variedad de estados moleculares.
Para entender esto volvamos a la analogía de las luciérnagas. Imaginemos que la intensidad de la luz emitida por cada luciérnaga depende de su estado de ánimo: una luciérnaga feliz emite más luz; una triste, menos. Una medición tradicional de la felicidad de las luciérnagas consistiría en tomar una porción de aire con un número conocido de luciérnagas, medir la intensidad de luz emitida y calcular cuánto contribuye cada insecto. Es decir, conoceríamos en promedio cuán felices se encuentran las luciérnagas, pero nada podríamos decir sobre la distribución de la felicidad entre los individuos. El mismo resultado se obtendría si solo existieran dos grupos de insectos, unos extremadamente tristes y otros enormemente felices, o en el caso de que todas las luciérnagas lo estuviesen medianamente. La figura 2 muestra cómo muy diversas distribuciones de una variable pueden dar como resultado el mismo valor promedio.
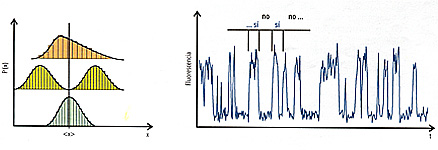
•Figura 2. Izquierda. Ejemplos de distribuciones de probabilidad diferentes de un parámetro (x) con el mismo valor promedio (<x>). Derecha. Intermitencia en la emisión de fluorescencia de una molécula individual. En este caso se debe a excursiones a estados no emisivos. Señales similares se obtienen debido a otros cambios de estado molecular, como de oxidación-reducción, o cambios conformacionales.
En sistemas moleculares complejos, ese efecto puede ser muy importante, ya que es posible que haya moléculas individuales que respondan de manera exactamente opuesta a un estímulo. En ese caso el resultado de una medición tradicional sería nulo, pues los valores de unas compensarían a los de las otras en el promedio, y la existencia de tales respuestas moleculares permanecería oculta. Solo la medición de las respuestas de moléculas individuales revelaría la verdadera situación. En la práctica, existen muchísimos sistemas de gran complejidad y heterogeneidad, como los vidrios, los polímeros o los sistemas biológicos por nombrar algunos, en los que las mediciones del comportamiento de moléculas individuales son especialmente importantes.
Monitoreo temporal de procesos
Otra ventaja importante de las mediciones de moléculas individuales es que permiten seguir fácilmente la evolución temporal de los procesos. Retornando a las luciérnagas, imaginemos una población de ellas con síndrome bipolar (muy común entre las luciérnagas también en estos días de tanto estrés, hemos sabido). Cada insecto pasaría por períodos de euforia en los que emitiría grandes cantidades de luz, y por períodos de depresión en que casi no lo haría. Una medición tradicional llevada a cabo sobre un gran número de luciérnagas haría creer que todas están más o menos bien todo el tiempo y los cambios de estado de ánimo pasarían inadvertidos. La única manera de enterarnos de la bipolaridad anímica es seguir en el tiempo la emisión de luz de cada luciérnaga.
Lo mismo ocurre con moléculas. Tomemos a las enzimas, que forman o degradan sustancias químicas mediante pasos catalíticos secuenciales o procesos enzimáticos. En una medición tradicional de un gran número de enzimas, incluso si se sincroniza el comienzo del proceso enzimático de todas ellas, es imposible obtener información sobre los pasos catalíticos siguientes, ya que las transiciones dinámicas de las enzimas individuales son aleatorias y no están relacionadas entre ellas. En cambio, si se observan las enzimas una por una se puede analizar la secuencia específica de los pasos catalíticos, la duración de cada etapa y su resultado. Es decir, se tiene acceso al proceso enzimático en todo su detalle. Es más, siguiendo las moléculas individualmente y realizando mediciones adecuadas en el tiempo, es posible que se pongan en evidencia pasos intermedios no frecuentes, que en una medición de conjunto quedarían ocultos.
Lo anterior se puede leer en un artículo sobre catálisis enzimática de Sunney Xie, de la Universidad de Harvard, y otros, citado entre las lecturas sugeridas, quienes estudiaron la oxidación de colesterol por la enzima colesterol oxidasa. Esta enzima posee un cofactor que no es fluorescente en el estado reducido, pero lo es en el estado oxidado. Con ello se tiene una marca del funcionamiento de la enzima. La sucesión de estados encendidos (oxidados) y apagados (reducidos) da una medida de la frecuencia de su actividad enzimática y de la duración de cada paso. Estos procesos se pueden seguir con una resolución temporal que depende en gran medida de la velocidad de colección de fotones originados en una misma molécula y que es del orden de los 100 microsegundos (millonésimas de segundo, ms) .
LAS MICROSCOPIAS MODERNAS: EL SONDEO MOLECUIAR
La expresión microscopios tradicionales utilizada en los inicios del artículo se refiere a los microscopios ópticos. Los más antiguos inventados en el afán de poder ver objetos demasiado pequeños para que los distinga el ojo humano. Los primeros datan de alrededor de 1600. Hacia 1930 aparecieron los microscopios electrónicos, que usan un haz de electrones, en lugar de un haz de fotones, para irradiar la muestra.
A principios de la década de 1980 se desarrollaron los microscopios con sondas de barrido superficial. Operan moviendo con gran precisión una punta muy aguda, llamada sonda, sobre una superficie, y midiendo la interacción entre ambas. Según la interacción que se procure medir, será la variante utilizada de esta microscopia. Por ejemplo, en la microscopia de fuerza atómica (AFM), la sonda está unida a un resorte muy sensible que permite medir la fuerza ejercida sobre ella. Cuando barre la superficie a distancia fija, la fuerza ejercida sobre la sonda provee información sobre la topología de esta. Si se estudian superficies ultraplanas, como un plano cristalográfico de oro o de grafito, se puede medir la topografía de moléculas adsorbidas sobre ellas. Otro ejemplo es la microscopia de efecto túnel. En este caso se usan sondas conductoras, se aplica una diferencia de potencial entre la sonda y la superficie, y se mide la corriente. Se denomina microscopia de efecto túnel porque no existe un contacto eléctrico entre la sonda y la muestra. Los electrones deben pasar de una a otra mediante el efecto túnel cuántico, un proceso que ocurre a distancias muy pequeñas. Esta técnica permite determinar la distribución de los orbitales de electrones de las moléculas.
La microscopia de fluorescencia es una microscopia óptica, con la particularidad de que la luz usada para iluminar la muestra es diferente de la luz detectada. Se usa frecuentemente con moléculas fluorescentes o marcadores, que dan origen a la luz detectada. Se ilumina la muestra con luz de longitudes de onda adecuadas para excitar transiciones electrónicas en esas moléculas. Para ello se utilizan láseres. Se detecta exclusivamente luz de longitudes de onda correspondientes a la emisión de los marcadores y se emplean filtros ópticos en la detección. El filtrado por colores de las luces de excitación y de emisión permite detectar selectivamente la luz proveniente de los marcadores. Como consecuencia, una imagen de microscopia de fluorescencia se ve oscura, salvo donde están presentes los marcadores. |
Resolución espacial de procesos y superresolución
¿Con qué precisión podemos determinar la posición de una molécula? El poder de resolución de un microscopio óptico tradicional está dado por el llamado límite de difracción o límite de Abbe, el cual establece el detalle mínimo que puede observarse en un objeto o, dicho de otra manera, la distancia mínima que debe haber entre dos puntos emisores de luz para poder distinguir uno del otro. También se puede decir que es el tamaño mínimo con el que se puede observar una fuente de luz.
El límite de difracción de un sistema óptico está dado aproximadamente por el cociente de la longitud de onda y la apertura numérica o potencia de la lente utilizada. Las lentes más potentes de un microscopio óptico tienen aperturas numéricas del orden de 0,4 a 1,4. Considerando las longitudes de onda de la luz visible, vemos que la resolución de un microscopio óptico puede oscilar entre los cientos de nanómetros a algunos micrómetros (milésimas de milímetro, µm). Pero las macromoléculas de mayor tamaño, como las proteínas, no superan los 100nm. En consecuencia, a los fines prácticos, cualquier molécula puede considerarse como un punto emisor de luz. Así, las señales de fluorescencia de moléculas individuales tienen una distribución espacial que está descripta aproximadamente por una función gaussiana (o campana de Gauss) con un ancho determinado por el límite de difracción (figura 1, derecha).
Sin embargo, de la misma manera que el pico de una montaña puede ubicarse con precisión independientemente del ancho de la base, la exactitud con la que se puede determinar la posición de una molécula no depende del límite de difracción. Claramente, las señales tienen un ancho de cientos de nanómetros, pero su centro, el lugar donde se encuentra la molécula, puede determinarse con precisión mucho mayor. Una de las maneras de determinar el centro de las señales es ajustar la distribución espacial de la luz por una función gaussiana bidimensional, en cuyo caso la ubicación de las moléculas se determina con una precisión que depende únicamente del número de fotones detectados. Por ejemplo, si se analiza una señal de 10.000 fotones provenientes de una molécula, su posición se puede determinar con una precisión de alrededor de 2nm.
La localización precisa de moléculas individuales ha permitido dos nuevos tipos de experimentos. Por un lado, el seguimiento espacial de procesos moleculares con resolución nanométrica. Por ejemplo, Paul Selvin, de la Universidad de Illinois en Urbana-Champaign, develó el mecanismo molecular de desplazamiento de la proteína miosina-V sobre microtúbulos del esqueleto celular. Por otro lado, se ha desarrollado toda una gama de técnicas de microscopia de fluorescencia con resolución nanométrica (también llamadas nanoscopias o microscopias con superresolución) .En la figura 3 se muestra esquemáticamente cómo funcionan esas técnicas.
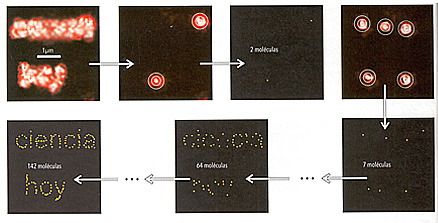
• Figura 3. La microscopia de superresolución por localización de moléculas individuales se basa en activar solo algunas moléculas a la vez, que se encuentren suficientemente espaciadas como para poder ubicar sus posiciones con alta precisión. Se va construyendo una imagen artificial marcando la posición de cada molécula con píxeles cuyo tamaño representa la incertidumbre en la determinación de la posición. De esta manera pueden resolverse detalles que serían invisibles si todas las moléculas estuviesen activas a la vez, como están en el primer gráfico.
Establecimiento de orientaciones moleculares
Otra característica importante de la detección óptica de moléculas individuales es que tanto la absorción como la emisión de luz son direccionales. En otras palabras, una molécula no absorbe ni emite luz con igual probabilidad en todas direcciones. Controlando la polarización de la luz utilizada para excitarla, o bien midiendo la polarización de la luz emitida, es posible determinar la orientación de la molécula y de este modo monitorear cambio rotacionales. Por ejemplo, la enzima ATPasa (ATP significa adenosina trifosfato) es una proteína de las membranas celulares que tiene tres dominios distribuidos alrededor de un eje. Mediante mediciones en moléculas individuales de ATPasa se ha observado que esa enzima degrada la ATP en pasos, asociados con sendas rotaciones moleculares de 120° de amplitud y siempre en el mismo sentido.
Otras aplicaciones
Como una molécula solo puede absorber y emitir un fotón por vez, se logra, entre otras cosas, realizar comunicación cuántica, que consiste en la transmisión de información codificada en propiedades de fotones individuales.
Otro campo de aplicación es el funcionamiento de antenas ópticas, que son estructuras de tamaño nanométrico con la capacidad de concentrar y dirigir luz en regiones nanométricas.
Conclusiones
Hemos presentado el concepto de detección de moléculas individuales y descripto el tipo de información que únicamente puede obtenerse mediante mediciones de ellas: (I) información sobre poblaciones presentes en una muestra y su distribución; (II) seguimiento temporal de procesos únicos; (III) seguimiento espacial y obtención de imágenes con resolución nanométrica y (IV) seguimiento de procesos moleculares de rotación. La detección, la espectroscopia y el seguimiento de moléculas individuales han significado un gran avance del conocimiento y proporcionado valiosa información sobre la química y la física de materiales, las propiedades de sistemas nanométricos y el funcionamiento de procesos biológicos. El campo de aplicación de las mediciones de moléculas individuales está en plena expansión; se puede anticipar que brinde información cada vez más detallada sobre el mundo microscópico.
|
|




